Questões Militares
Sobre sistemas homogêneos: solubilidade dos sais, hidrólise dos sais e curvas de titulação. em química
Foram encontradas 32 questões
Considere as curvas de solubilidade.
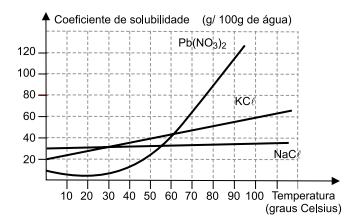
(Estudo gráfico do coeficiente de solubilidade – Manual da Química (manualdaquimica.com))
Ao preparar soluções aquosas com cada um dos sais,
separadamente, dissolvendo 10 g do sal em 50 g de
água a 40 ºC, observa-se formação de corpo de fundo
na solução de
Os principais parâmetros que definem a qualidade da água de uma piscina são o pH e a alcalinidade. Para a água ser considerada própria, o pH deve ser mantido próximo de 7,0, para garantir o conforto do banhista e a eficácia dos agentes bactericidas. Já a alcalinidade, expressa em concentração de íon bicarbonato, deve ser em torno de 100 g m-3 . A propriedade anfotérica desse íon garante que qualquer substância ácida ou básica introduzida seja prontamente neutralizada, conforme mostram as equações químicas abaixo:
HCO3 - (aq) + H+ (aq) ⇄ H2O(l) + CO2(g)
HCO3 - (aq) + OH- (aq) ⇄ H2O(l) + CO3 2- (aq)
Ao adicionar carbonato de sódio na água de uma piscina, que está em condições consideradas adequadas para o banho, ocorrerá:
A adsorção é um fenômeno de superfície no qual espécies em fase líquida ou gasosa, chamadas adsorvatos, ligam-se à superfície do adsorvente por meio de interações físicas, químicas ou ambas. Além da catálise heterogênea, a adsorção também é aplicada à purificação de gases e a o tratamento de efluentes líquidos, entre outros usos. Para determinar o grau de recobrimento da superfície do adsorvente, como uma função da concentração do adsorvato no meio líquido ou gasoso, à temperatura constante, são estabelecidas as isotermas de adsorção.
O processo de adsorção pode ser representado por meio da seguinte equação
A + S ⇌ AS
em que A é o adsorvato, no estado líquido ou gasoso, S representa o sítio vazio na superfície do adsorvente e AS representa o sítio ocupado por A na superfície do adsorvente.
A adsorção de ácido acético em carvão ativado pode ser descrita pela isoterma de Freundlich, expressa pela seguinte equação
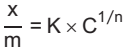
em que x é a massa de material adsorvido, m é a massa de material adsorvente, K e n são as constantes
do modelo e C é a concentração da solução (g.L-1) no equilíbrio. Os dados de equilíbrio para a adsorção de
ácido acético, a partir de soluções aquosas, em carvão ativado, são apresentados na figura a seguir.
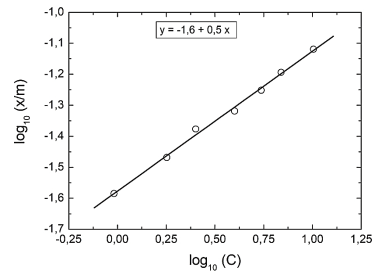
A partir dos dados apresentados no gráfico, é correto afimar que os valores das constantes K e n são,
respectivamente,
Assinale a opção que completa corretamente as lacunas da sentença abaixo:
O cloreto de prata é menos solúvel em uma solução de NaCI do que em água pura. Nesse caso, a redução de solubilidade pode ser explicada pelo fenômeno denominado_______, baseado no_________.
A figura abaixo demonstra a típica curva de titulação de uma substância.
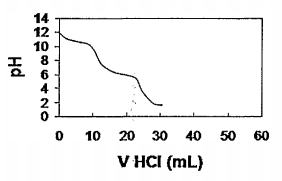
Que substância é indicada na figura acima?
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Com base nas informações obtidas pelo aluno, por meio do experimento descrito acima, indique a alternativa que apresenta uma conclusão INCORRETA a respeito deste experimento.
Com relação à natureza de precipitados, analise as afirmativas a seguir.
I - Na análise gravimétrica, o precipitado formado deve ser bastante solúvel.
II - Nos procedimentos clássicos, o reagente precipitante deve ser adicionado diluído e com agitação.
III - As partículas dos precipitados formados devem ser pequenas o suficiente para atravessarem os poros dos filtros.
Assinale a opção correta.
Coloque F (falso) ou V (verdadeiro), nas afirmativas abaixo, assinalando a seguir a opção correta.
( ) Na formação de um precipitado, é necessário considerar as etapas de nucleação e o crescimento dos cristais.
( ) Segundo a equação de Von Weimarn, quanto maior a concentração dos reagentes, maior o grau de dispersão e menor o tamanho das partículas.
( ) Precipitados formados por aglomeração coloidal são amorfos e porosos, com enormes áreas superficiais.
( ) É comum, nos procedimentos gravimétricos, deixar o precipitado repousar na presença da água mãe, durante um determinado tempo, antes de ser filtrado.
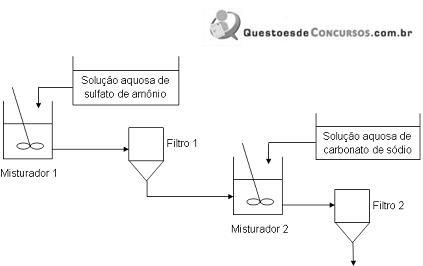
No Misturador 1, antes da adição de 100 mL de uma solução aquosa de sulfato de amônio 20 g/L, encontram-se 100 mL de uma solução aquosa composta por massas iguais de nitrato de prata, nitrato cúprico e nitrato de chumbo (II), de concentração total 60 g/L.
Ao Misturador 2, que contém o material passante do Filtro 1, adicionam-se 100 mL de uma solução aquosa de carbonato de sódio 40 g/L e uma pequena quantidade de uma solução de hidróxido de sódio objetivando o adequado ajuste do pH de precipitação para, em seguida, proceder a filtração. Sobre os produtos de filtração, pode se dizer que: