Questões Militares
Comentadas sobre soluções e substâncias inorgânicas em química
Foram encontradas 230 questões
“Solução saturada: solução que contém a quantidade máxima de soluto em determinada quantidade de solvente, a determinada temperatura; a relação entre quantidades máximas de soluto e quantidade de solvente é denominada de coeficiente de solubilidade”.
“Solução insaturada: quando a solução contém uma quantidade de soluto inferior ao seu coeficiente de solubilidade, na temperatura em que se encontra a solução”.
“Solução supersaturada: quando a solução contém uma quantidade de soluto dissolvido superior ao seu coeficiente de solubilidade, na temperatura em que se ela se encontra. É instável” .
USBERCO, João e SALVADOR, Edgard, Físico-química, São Paulo, Ed Saraiva, 2009, Pág. 18
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007, Pág. 18 e 19.
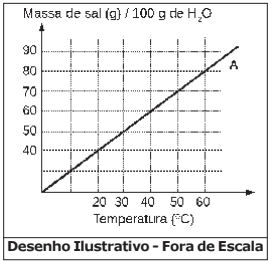
Considere o gráfico da curva de solubilidade em função da temperatura para um sal hipotético A. No gráfico, a linha contínua representa a solubilidade máxima do soluto (sal A) em 100 g de água na temperatura correspondente.
Acerca desse gráfico e processo de solubilidade são feitas as seguintes afirmativas:
I – Na temperatura de 20 ºC, misturando-se 50 g do sal A em 100 g de água, ter-se-á um sistema heterogêneo.
II – Na temperatura de 40 ºC, a adição de 50 g do sal A em 100 g de água produzirá uma solução insaturada.
III – 200 g de água dissolvem totalmente 90 g do sal A a 30 ºC.
IV – Uma solução contendo 60 g do sal A em 100 g de água será saturada em 60 ºC.
Das afirmativas feitas estão corretas apenas
I. NH4+ + NH2 – ➝ 2NH3 . II. CH3 NH2 + H2O ➝ CH3 NH3+ + OH– III. SO3 2– + S ➝ S2 O3 2–
As espécies que atuam como ácido nas reações representadas em I, II e III são, respectivamente,
Considere a curva de solubilidade da sacarose.
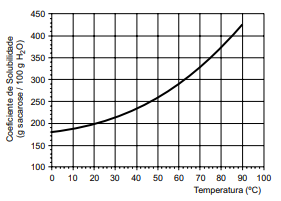
A temperatura em que se iniciou a cristalização e a massa máxima de açúcar cristalizada na solução em repouso a 20 ºC são, correta e respectivamente,
Completou-se o volume do balão com água destilada. Considerando que se empregou a técnica quantitativa na preparação da solução, a concentração de íons nitrato na solução preparada é
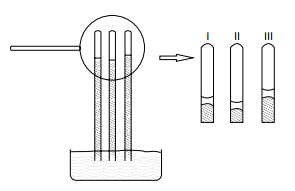
Nesse experimento, a água, a solução de cloreto de sódio e a solução de glicose estão contidas, respectivamente, nos tubos
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
I. A uma solução de nitrato de prata é adicionada uma solução de cloreto de sódio, com a formação de um precipitado. II. O precipitado obtido em (I) é filtrado e misturado a hidróxido de sódio sólido, com um pouco de água. A mistura é aquecida, produzindo um sólido marrom escuro. III. O sólido preparado em (II) é aquecido junto a uma solução concentrada de glicose, formando um sólido cinzento.
Assinale a alternativa que apresenta corretamente os sólidos produzidos em I, II e III, respectivamente.
 1, na solução resultante é igual a
1, na solução resultante é igual a 
O indicador vermelho de fenol apresenta cor amarela em
soluções aquosas de pH < 6,4, e, cor vermelha, em soluções
aquosas de pH > 8,2. Na água pura (pH = 7,0), esse indicador
apresenta cor laranja.
A uma amostra de água pura foi acrescentado o indicador vermelho de fenol. Em seguida, foi acrescentado certo óxido que mudou a cor apresentada por esse indicador de laranja para amarela. Esse óxido pode ter sido o
Considere as figuras I e II abaixo.
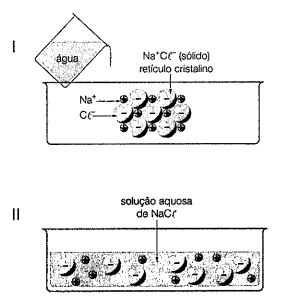
O fenômeno ocorrido na sequência I - II é denominado:
Considere as seguintes equações de neutralização.
H2SO4 + 2 NaOH → X + 2 H2O
H2SO4 + NaOH → Y + H2O
As substâncias que correspondem às letras X e Y são, respectivamente:
Um litro de uma solução de HCl com pH = 2 deve ser neutralizada com uma solução de NaOH 1 mol.L-1.
O volume, em mL, da solução básica necessário para realizar essa neutralização é igual a
Em um acidente ocorrido em Ribeirão Preto (SP), um caminhão tombou e provocou o vazamento de 25 litros de ácido nítrico (HNO3). Segundo informações do Corpo de Bombeiros Militar local, um dos compartimentos que transportavam esse produto caiu do caminhão e, ao bater no chão, a tampa se soltou e causou o derramamento do produto. O Corpo de Bombeiros Militar utilizou como reagente neutralizante do produto carbonato de sódio (Na2 CO3 ).
Disponível em: <http://g1.globo.com/sp/ribeirao-preto-franca/noticia/ 2013/11/ caminhao-tomba-e-causa-vazamento-de-acidoem-rodovia-de-ribeirao-preto.html>. Acesso em: out. 2018. [Fragmento adaptado].
Sabe-se que o reagente derramado tem as seguintes características:
1. Densidade igual a 1,5 g/mL.
2. Percentual em massa igual a 60%.
Nessas condições, é correto afirmar que a massa de carbonato de sódio, em quilogramas, que reagiu completamente com o ácido para neutralizá-lo é de, aproximadamente,
É requerido que fazendas produtoras de leite bovino controlem a acidez do leite que está aguardando o processamento. Essa acidez é resultante da conversão da lactose em ácido lático (ácido 2-hidroxipropanoico) por ação de microrganismos:
C12H22O11 + H2O → 4C3H6O3
Um fazendeiro decidiu fazer um experimento para determinar a taxa de geração de ácido lático no leite armazenado: retirou uma amostra de 50 cm3 de leite, cuja concentração de ácido lático é de 1,8 g/L, e, depois de três horas, utilizou 40 cm3 de uma solução 0,1 molar de NaOH para neutralizá-la.
Conclui-se que a taxa média de produção de ácido lático por litro de leite é:
Observe a reação a seguir:
HCI(aq) + NaOH(aq) → NaCI(aq) + H2O(I)