Questões Militares
Sobre substâncias e suas propriedades em química
Foram encontradas 298 questões
Ponto de ebulição dos hidretos do grupo 4A e 6A em função da massa molecular.
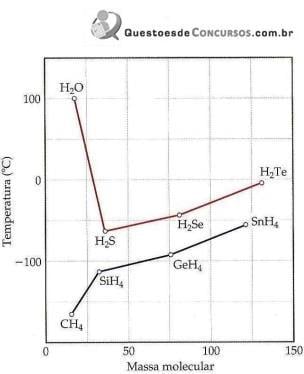
(Química Ciência Central.)
Sobre a imagem e intensidade das forças intermoleculares, analise.
I. No geral, o ponto de ebulição de compostos de hidrogênio torna-se maior com o aumento da massa molecular, devido ao acréscimo das forças de dispersão.
II. Os compostos NH3 e HF também têm pontos de ebulição altos.
III. A ligação de hidrogênio é um tipo de atração intermolecular entre o átomo de hidrogênio em uma ligação apolar (particularmente uma ligação com F, O ou N) e um par de elétrons não compartilhado em um íon ou átomo pequeno e eletronegativo que esteja próximo (geralmente um átomo de F, O ou N em outra molécula).
Está(ão) correta(s) apenas a(s) afirmativa(s)
Analise as afirmativas abaixo, relacionadas aos compostos iônicos .
I - Apresentam elevados pontos de fusão e de ebulição.
II - São sólidos nas condições ambientes de temperatura e pressão.
III- Conduzem corrente elétrica quando dissolvidos em água.
IV - São exemplos de compostos iônicos: Cloreto de Sódio e Diamante.
Assinale a opção correta.
I. Em uma solução de NaCℓ em água há interações íon-dipolo. II. Em uma solução de oxigênio (O2) em água há interações dipolo - dipolo induzido. III. Em uma solução de iodo (I2) em tetracloreto de carbono (CCℓ4) há interações dipolo instantâneo-dipolo induzido.

Pb(s) + PbO2(s) + 2H2SO4(aq) → 2Pb2+ SO4 2- (aq) + 2H2O(ℓ)
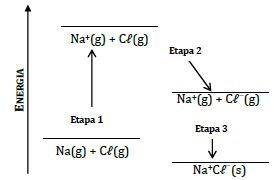
As energias envolvidas nas etapas 1, 2 e 3 são denominadas, respectivamente:
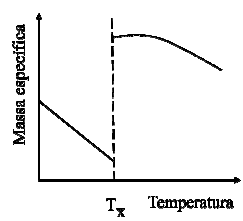
I. Líquidos evaporam em qualquer temperatura. II. A temperatura de ebulição normal de um dado líquido independe das partículas formadoras. III. Líquidos distintos apresentam a mesma pressão de vapor nas respectivas temperaturas de ebulição normal. IV. A tensão superficial de um dado líquido varia diretamente com a temperatura.
Para uma molécula diatômica, a energia potencial em função da distância internuclear é representada pela figura ao lado. As linhas horizontais representam os níveis de energia vibracional quanticamente permitidos para uma molécula diatômica. Uma amostra contendo um mol de moléculas diatômicas idênticas, na forma de um sólido cristalino, pode ser modelada como um conjunto de osciladores para os quais a energia potencial também pode ser representada qualitativamente pela figura. Em relação a este sólido cristalino, são feitas as seguintes proposições:
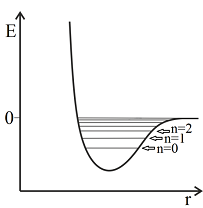
I. À temperatura de 0 K, a maioria dos osciladores estará estado vibracional fundamental, cujo número quântico vibracional, n, é igual a zero.
II. À temperatura de 0 K, todos os osciladores estarão no estado vibracional fundamental, cujo número quântico vibracional, n, é igual a zero.
III. O movimento vibracional cessa a 0 K.
IV. O movimento vibracional não cessa a 0 K.
V. O princípio de incerteza de Heisenberg será violado se o movimento vibracional cessar.
Das proposições acima estão CORRETAS
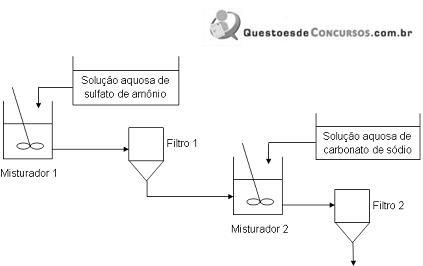
No Misturador 1, antes da adição de 100 mL de uma solução aquosa de sulfato de amônio 20 g/L, encontram-se 100 mL de uma solução aquosa composta por massas iguais de nitrato de prata, nitrato cúprico e nitrato de chumbo (II), de concentração total 60 g/L.
Ao Misturador 2, que contém o material passante do Filtro 1, adicionam-se 100 mL de uma solução aquosa de carbonato de sódio 40 g/L e uma pequena quantidade de uma solução de hidróxido de sódio objetivando o adequado ajuste do pH de precipitação para, em seguida, proceder a filtração. Sobre os produtos de filtração, pode se dizer que:
Dados: 1H1; 6C12; 8O16; 16S32; 7N14