Questões Militares
Sobre substâncias e suas propriedades em química
Foram encontradas 303 questões
Assinale a opção que apresenta as espécies que sofrem oxidação e redução, respectivamente, na reação a seguir:
CuS(s) + o2(g) Cu(s) + So2(g)
Os processos de corrosão são considerados reações químicas heterogêneas ou reações eletroquímicas que se passam geralmente na superfície de separação entre o metal e o meio corrosivo. A caracterização da forma de corrosão auxilia bastante no esclarecimento do mecanismo e na aplicação de medidas adequadas de proteção. Relacione as formas de corrosão às suas respectivas características fundamentais e, em seguida, assinale a alternativa que apresenta a sequência correta.
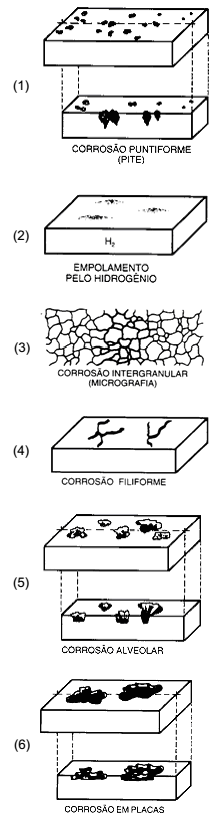
(Gentil, Vicente, 2007)
( ) a corrosão se processa entre os órgãos da rede cristalina do
material metálico.
( ) a corrosão se processa sob forma de finos filamentos, mas não profundos.
( ) o hidrogênio atômico penetra no material metálico, se transforma em hidrogênio molecular, exercendo pressão e originando a formação de bolhas.
( ) a corrosão se processa na superfície metálica produzindo sulcos ou escavações que apresentam fundo arredondado e profundidade geralmente menor que o seu diâmetro.
( ) a corrosão se processa em pontos ou pequenas áreas localizadas na superfície metálica produzindo cavidades que apresentam o fundo de forma angulosa e profundidade geralmente maior do que seu diâmetro.
( ) a corrosão se localiza em regiões da superfície metálica e não em toda sua extensão, formando placas com escavações.
Os espetáculos produzidos por fogos de artifício são resultados de diversas reações químicas. Nos primórdios, as cores desses artefatos estavam limitadas ao dourado e ao prateado por serem estas resultantes da mistura de carvão e limalha de ferro. Em 1786, com a descoberta do clorato de potássio KCℓO3 pelo químico francês Claude Louis Berthollet e, com a disponibilidade dos elementos magnésio e alumínio, o universo de cores dos fogos de artifício ganhou matizes, luminosidade e brilho.
In: Ciência Hoje, v. 48, n.º 288, 2011, p. 27-8 (com adaptações).
As moléculas ΦOF4, ΨF4 e ΩF5 apresentam, respectivamente, formas geométricas que se aproximam das figuras (1), (2) e (3), mostradas a seguir, no modelo de bola e palito:
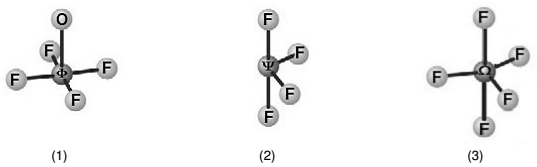
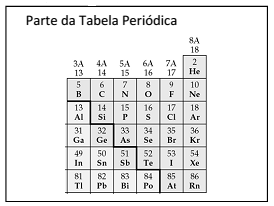
Sabendo-se que “Φ“, “Ψ” e “Ω” representam elementos da tabela periódica, assinale a alternativa correta que indica, na sequência, as possíveis identidades destes elementos:
Os átomos de um elemento Z cujo número atômico é 20 se unem com os átomos de um elemento Y cujo número atômico é 7 através de uma ligação iônica. Qual a fórmula do composto formado por esses dois elementos?
Os aniontes podem ser divididos em grupos, de acordo com seu comportamento em relação a determinados reagentes.
O grupo volátil são aniontes que, pela adição de ácidos diluídos, não oxidantes, formam produtos gasosos. Assinale a opção em que o anionte pertence ao grupo volátil.
100ml de uma solução aquosa contendo 0,2g de um analito é submetida a uma extração líquido-líquido, por agitação, com 50ml de um solvente orgânico. Sabe-se que a razão de distribuição para o analito é de 1/ 80, isto é, ele é 80 vezes mais solúvel na fase orgânica do que em água. Qual o peso de analito extraído da solução aquosa?
Dado: xn =
xaq(DV/ (DV + 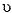 ) )n
) )n
onde: D = Razão de distribuição
V = Volume da solução aquosa
Xaq = Peso do soluto
n = n° de extrações
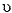 = Volume do solvente
= Volume do solvente
xn = Peso do soluto remanescente na fase aquosa
Leia o fragmento a seguir.
A obtenção do Sal
“Ao longo de toda a história o homem coletou ou produziu sal. Os três principais métodos de produzi-lo – evaporação, fervura da água salgada e mineração de sal-gema – foram utilizados na Antiguidade e continuam em uso atualmente. A evaporação da água do mar pelo Sol era (e continua sendo) o método mais comum de produção em regiões litorâneas tropicais.”
(Fonte:LE COUTER, P e BURRESON, J. Os Botões de Napoleão, Rio de Janeiro:Zahar.)
Em laboratório, o processo de obtenção do sal, a partir de água salgada, é denominado destilação, método utilizado para separar
Com o objetivo de analisar a fusão e a ebulição de alguns materiais inertes entre si, foi criada a tabela a seguir.
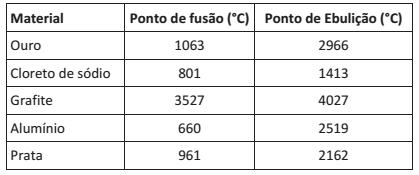
O experimento consistia em colocar em um recipiente uma barra de 20 g de ouro, 100 g de cloreto de sódio, 50 g de grafite, uma barra de 200 g de alumínio e um bloco de 30 g de prata e elevar a temperatura do recipiente a 1.000°C.
Com base na tabela, encontraremos no recipiente: