Questões Militares
Sobre teoria atômica: modelo atômico de dalton, thomson, rutherford, rutherford-bohr em química
Foram encontradas 45 questões
“O tubo de uma televisão é composto por um gerador de elétrons em uma ponta e uma tela de vidro revestida com sais de fósforo na outra ponta. Os elétrons, quando batem neste sal da tela, o fazem brilhar e vemos um ponto luminoso (fosforescência).”
(https://pt.quora.com/Como-as-TVs-de-tubo-eram-as-imagens. Adaptado)
Os modelos atômicos que primeiro explicaram a presença de elétrons no átomo e o fenômeno da fosforescência, são, em ordem cronológica,
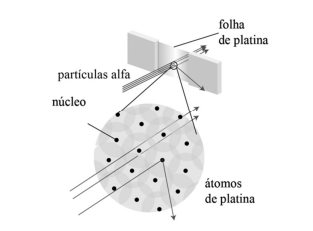
Internet: <integrada.minhabiblioteca.com.br> (com adaptações)
Em busca de respostas, esse cientista propôs o experimento e o modelo atômico da figura precedente e, ainda, inferiu que, quando uma dessas partículas com carga positiva atingia diretamente um dos núcleos de platina — muito pequeno, porém, muito pesado —, a partícula sofria um desvio muito grande, como se uma bola de tênis tivesse se chocado com uma bola de canhão parada.
Com base nessas informações, assinale a opção em que é apresentado o nome do cientista que propôs a referida explicação.
II. O modelo de Dalton contém o arcabouço teórico minimamente necessário para representar uma equação do tipo: 12 Fe(s)+ C(s) → Fe12C(s).
III. O modelo de Rutherford contém o arcabouço teórico minimamente necessário para representar uma equação do tipo: 24He2+ + Au → 24He2+ + Au.
IV. O modelo de Thomson contém o arcabouço teórico minimamente necessário para representar uma equação do tipo: 2H+ + 2e- ⇋ H2.
Assinale a opção que contém a(s) afirmação(ões) CORRETA(S) sobre a relação entre os
modelos atômicos e as equações químicas mostradas.
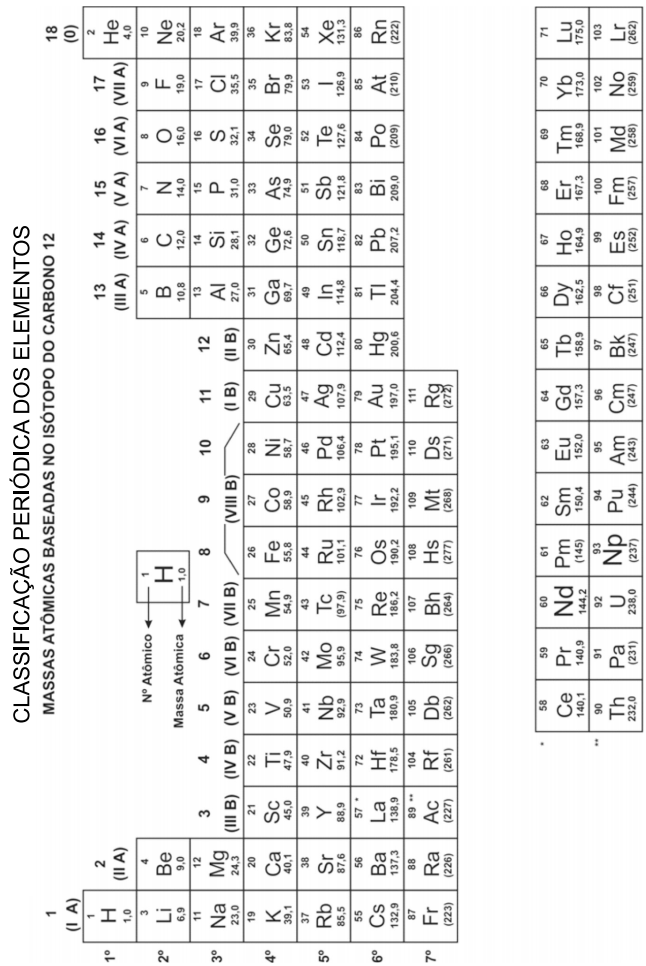
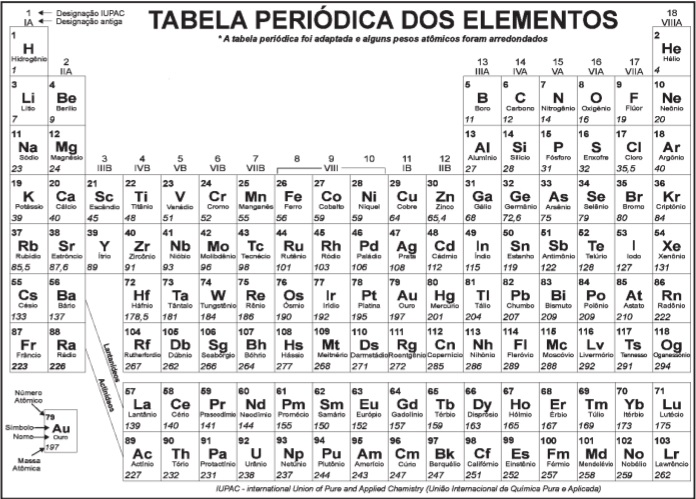
Número atômico dos elementos: O=8; F=9; Na=11.
Uma das pesquisas realizadas no século 19, que foi de grande importância para o desenvolvimento dos modelos atômicos, empregava um dispositivo conhecido como ampola ou tubo de Crookes.
Com esse tipo de dispositivo, foram estudados os raios catódicos, que eram de fato ----------- que se direcionavam para o polo ----------- do tubo.
As lacunas são preenchidas, correta e respectivamente, por
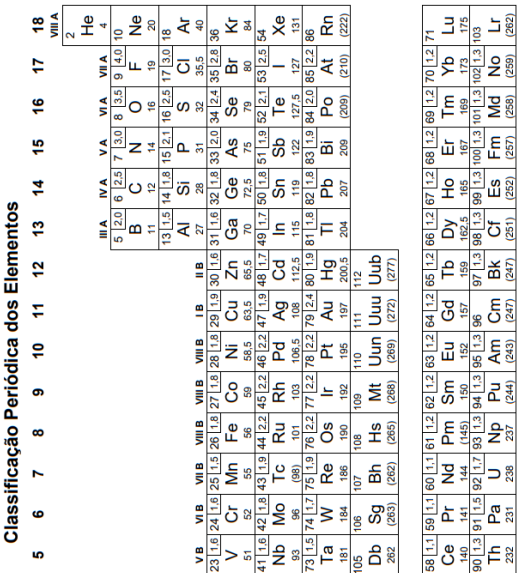
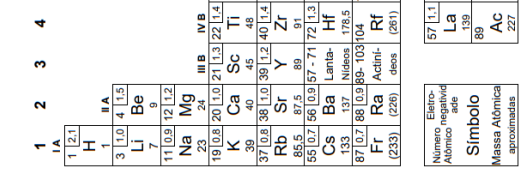
A configuração eletrônica do escândio, no estado fundamental, é:
As ideias sobre os átomos e sua composição passaram por diversas modificações ao longo dos anos. A partir de estudos, foram propostos alguns modelos que explicariam de que seria formada a menor parte que constitui a matéria. Analise a seguir os modelos propostos e seus respectivos cientistas responsáveis:
I. O átomo é uma esfera maciça, indestrutível e que pode ser dividido - Dalton
II. O átomo é uma esfera maciça de carga positiva encrustada de elétrons - Thomson
III. O átomo possui um núcleo positivo, com elétrons girando ao seu redor – Rutherford
A correlação entre o cientista e suas ideias está correta
A tabela mostra a distribuição eletrônica, em níveis de energia, do átomo do gás nobre argônio, Ar.
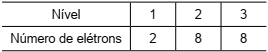
Dois dos íons que apresentam essa mesma distribuição eletrônica são:

Experimentos foram realizados, bombardeando cada material com uma quantidade de partículas a e registrando o número de partículas coletadas em cada detector, conforme a tabela abaixo.
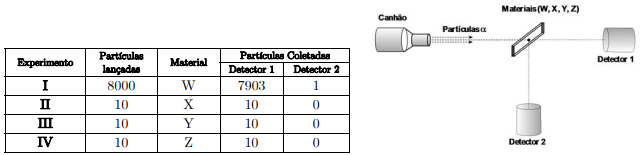
A partir dessas informações, assinale a alternativa que apresenta a conclusão CORRETA sobre as observações feitas nos experimentos.
Uma pesquisa recente propõe a identificação de resíduos de armas de fogo por meio de marcadores luminescentes, formados por compostos de lantanídeos. Esses compostos, adicionados à parte interna da munição, espalham-se no chão, mãos e roupas, após o disparo de uma arma, podendo ser detectados com luz negra. Quatro cores podem ser aplicadas ao procedimento:

Sabe-se que a cor de um átomo resulta das transições de seus elétrons entre os subníveis de energia. A cor do lantanídeo cujos átomos apresentam nove elétrons em seu subnível de maior energia no estado fundamental é:
Com os uniformes cobertos de barro, os militares bombeiros estavam por todos os lados no mar de lama e detritos que arrasou a cidade de Brumadinho devido ao acidente da barragem ocorrido no ano de 2019. A lama de rejeito provocou um rastro de destruição ao longo do Rio Paraopeba. Segundo especialistas, em toda a extensão percorrida, a água do rio não tinha condições para o consumo humano e animal. Dentre vários contaminantes, encontraram-se metais em altas concentrações como ferro, cobre, manganês e cromo.
Sobre os metais citados no texto, aquele que, quando o átomo se encontra ionizado no estado de oxidação +2 apresentará a configuração eletrônica 1s2 2s2 2p6 3s2 3p6 3d5 é o:
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

(1) A intensidade da luz depende da frequência ou do comprimento de onda da radiação empregada. (2) Dentre as cores do espectro visível, a azul é a que possui maior intensidade devido ao seu menor comprimento de onda. (3) Dentro do espectro visível, a luz vermelha é a radiação que possui o menor comprimento de onda. (4) O estado do elétron em um átomo é completamente definido pelos números quânticos n, l, ml . (5) A configuração eletrônica dos átomos é determinada pelo princípio da construção, pelo princípio da exclusão de Pauli e pela regra de Hund. (6) Na tabela periódica, os pares de elementos com relação diagonal geralmente exibem propriedades químicas semelhantes.
A soma dos números associados às sentenças ERRADAS é igual a
Esse experimento refere-se ______ e à emissão de ______ .
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
CIENTISTAS
I- Dalton II- Thomson III Rutherford IV- Chadwick
DESCOBERTAS
( ) Descobriu os nêutrons em 1932, durante experiências com material radioativo. ( )Foi o primeiro modelo científico para o átomo e era semelhante a uma bola de bilhar. ( )Propôs um modelo atómico semelhante a pudim de passas. ( )Criou um modelo atomico semelhante à disposição dos planetas no sistema solar
Modelo Característica(s) do Modelo I Átomo contém espaços vazios. No centro do átomo existe um núcleo muito pequeno e denso. O núcleo do átomo tem carga positiva. Para equilíbrio de cargas, existem elétrons ao redor do núcleo. II Átomos maciços e indivisíveis. III Elétrons movimentam-se em órbitas circulares em torno do núcleo atômico central. A energia do elétron é a soma de sua energia cinética (movimento) e potencial (posição). Essa energia não pode ter um valor qualquer, mas apenas valores que sejam múltiplos de um quantum (ou de um fóton). Os elétrons percorrem apenas órbitas permitidas.
A alternativa que apresenta a correta correlação entre o cientista proponente e o modelo atômico por ele proposto é
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
Esse experimento refere-se___________ e à emissão de______________ .
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
Acerca das informações químicas do elemento sódio que podem ser extraídas do texto “Na onda do sódio”, considere as seguintes afirmativas:
1. Da afirmativa “Minha família é a um”, pode-se concluir que sódio pertence à família I e, portanto, possui configuração eletrônica finalizada em ns 1 .
2. Da afirmativa “Meu período é o terceiro”, interpreta-se que a configuração eletrônica é preenchida até o nível n = 3.
3. O cloro é o “halogênio especial”, pois é com o qual o sódio reage para formar o cloreto de sódio.
4. No sal de cloreto de sódio, a configuração eletrônica do cátion Na+ é preenchida até o nível n = 2, finalizando em 2s 2 , 2p 6 .
Assinale a alternativa correta.
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Considere as seguintes proposições a respeito dos valores, em módulo, da energia de orbitais atômicos 2s e 2p:
I. |E2s| = |E2p| para o átomo de hidrogênio.
II. |E2s| = |E2p| para o íon de hélio carregado com uma carga positiva.
III.|E2s| > |E2p| para o átomo de hélio.
Das proposições acima, está(ão) CORRETA(S)