Questões Militares
Sobre teoria atômica: modelo atômico de dalton, thomson, rutherford, rutherford-bohr em química
Foram encontradas 45 questões
A respeito da matéria e de sua constituição química, julgue o item a seguir.
De acordo com o modelo atômico de Rutherford, os átomos
são constituídos de elétrons, prótons e nêutrons.
A respeito da matéria e de sua constituição química, julgue o item a seguir.
Elemento químico pode ser considerado um conceito teórico,
por ser definido como tipo de átomos, também definido por
um número atômico.
Moléculas de lítio não existem no estado líquido ou sólido, mas, sem dúvida, as moléculas diatômicas são encontradas no lítio gasoso. A energia de ligação do Li2 é 105 kJ/mol.
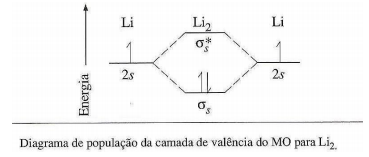
Sobre o diagrama de população da camada de valência do MO para Li2, analise as afirmativas a seguir.
I. A ordem de ligação é 1/2.
II. A configuração eletrônica de Li2 pode ser escrita como KK (σs)2 .
III. A energia de ligação do Li2 é menor do que H2 porque há uma blindagem do núcleo pela camada K completa de cada átomo.
Está(ão) correta(s) apenas a(s) afirmativa(s)
O modelo atômico de Bohr contribuiu muito para a implantação do modelo atual. Uma das contribuições foi a proposição de que os elétrons existem apenas em níveis de energia distintos e que são descritos pelos números quânticos. Dentro desse contexto, Bohr inseriu no vocabulário científico a ideia de estados fundamentais e excitados para descrever o comportamento dos elétrons nos átomos.
Considerando essas informações, assinale a alternativa que representa a configuração eletrônica em que o átomo se encontra no estado excitado.
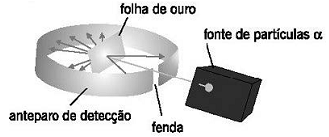
Disponível em:: <http://objetoseducacionais2.mec.gov.br/bitstream/handle/mec/12908/08_avaliacao.htm> . Acesso em: 11 jan. 2016.
Com esse experimento, é possível concluir:
Para uma molécula diatômica, a energia potencial em função da distância internuclear é representada pela figura ao lado. As linhas horizontais representam os níveis de energia vibracional quanticamente permitidos para uma molécula diatômica. Uma amostra contendo um mol de moléculas diatômicas idênticas, na forma de um sólido cristalino, pode ser modelada como um conjunto de osciladores para os quais a energia potencial também pode ser representada qualitativamente pela figura. Em relação a este sólido cristalino, são feitas as seguintes proposições:
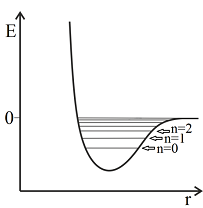
I. À temperatura de 0 K, a maioria dos osciladores estará estado vibracional fundamental, cujo número quântico vibracional, n, é igual a zero.
II. À temperatura de 0 K, todos os osciladores estarão no estado vibracional fundamental, cujo número quântico vibracional, n, é igual a zero.
III. O movimento vibracional cessa a 0 K.
IV. O movimento vibracional não cessa a 0 K.
V. O princípio de incerteza de Heisenberg será violado se o movimento vibracional cessar.
Das proposições acima estão CORRETAS
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
A concepção de átomo proposta por Rutherford permite explicar a coloração da chama emitida no processo de combustão do bário.
Um experimento clássico indica que o oxigênio molecular (O2) exibe propriedades magnéticas no seu estado fundamental. O experimento consiste em fazer passar oxigênio líquido pelos polos de um ímã. Observa-se que o oxigênio fica retido, como mostra a figura a seguir:
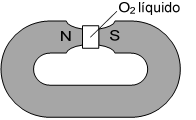
Nas alternativas abaixo, são apresentados os orbitais 2p de dois átomos de oxigênio e o spin dos elétrons que ocupam seus orbitais atômicos. Também são apresentadas possíveis interações químicas que podem resultar em ligações químicas estabelecidas entre esses dois átomos.
Considerando a observação experimental e os requisitos eletrônicos e energéticos para o
estabelecimento de ligações químicas, indique qual das alternativas abaixo representa melhor o O2 no
estado fundamental.
No modelo atômico de Bohr:
1. O elétron circula em órbita com raio definido.
2. O elétron é descrito por uma função de onda.
3. Para descrever o elétron num orbital são necessários 4 números quânticos.
4. Toda a massa do átomo está concentrada no núcleo, que ocupa uma porção ínfima do espaço.
Entre as afirmativas acima, correspondem ao modelo atômico de Bohr:
São dadas as seguintes afirmativas:
I – Joseph J. Thomson, em seu modelo atômico, descrevia o átomo como uma estrutura na qual a carga positiva permanecia no centro, constituindo o núcleo, enquanto as cargas negativas giravam em torno desse núcleo;
II – um átomo, no estado fundamental, que possui 20 elétrons na sua eletrosfera, ao perder dois elétrons, gerará um cátion bivalente correspondente, com configuração eletrônica – segundo o diagrama de Linus Pauling – igual a 1s2 2s2 2p6 3s2 3p6;
III – a afinidade eletrônica (eletroafinidade) aumenta conforme o raio atômico diminui. Dessa forma, devido ao seu menor raio atômico, o oxigênio (Z=8) possui maior afinidade eletrônica do que o enxofre (Z=16), ambos pertencentes à mesma família da Tabela Periódica;
IV – o raio de um íon negativo (ânion) é sempre menor que o raio do átomo que lhe deu origem.
Das afirmações feitas, utilizando os dados acima, estão corretas apenas:
Em ambientes fechados, o superóxido de potássio (KO2) é utilizado em máscaras de respiração, para remover o dióxido de carbono e a água do ar exalado. A remoção de água gera oxigênio para a respiração por meio da reação
4KO2(s) + 2H2O(l) → 3O2(g) + 4KOH(s). (I)
O hidróxido de potássio remove o dióxido de carbono da máscara pela reação
KOH(s) + CO2(g) → KHCO3(s). (II)
P. W. Atkins e L. Jones. Princípios de química. Rio de Janeiro: LTC, 2006, p. 125.
Com base nas informações acima, julgue o próximo item.
De acordo com o modelo atômico de Thomson, os átomos
de oxigênio da molécula de O2 podem ser representados por
esferas maciças e indivisíveis.