Moléculas de lítio não existem no estado líquido ou sólido, ...
Moléculas de lítio não existem no estado líquido ou sólido, mas, sem dúvida, as moléculas diatômicas são encontradas no lítio gasoso. A energia de ligação do Li2 é 105 kJ/mol.
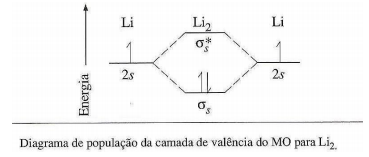
Sobre o diagrama de população da camada de valência do MO para Li2, analise as afirmativas a seguir.
I. A ordem de ligação é 1/2.
II. A configuração eletrônica de Li2 pode ser escrita como KK (σs)2 .
III. A energia de ligação do Li2 é menor do que H2 porque há uma blindagem do núcleo pela camada K completa de cada átomo.
Está(ão) correta(s) apenas a(s) afirmativa(s)
- Gabarito Comentado (1)
- Aulas (9)
- Comentários (3)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
De acordo com o diagrama de população da camada de valência do orbital molecular, para a molécula Li2, há dois elétrons em orbitais ligantes (σs) e nenhum elétron em orbitais antiligantes (σs*). Logo, obtemos que:
Ordem de ligação = 1/2 ∙ (2 - 0) = 1
Portanto, a afirmativa está incorreta.
Gabarito do Professor: Letra D.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
GAB: D
I - ERRADO. O.L. = Ligante-Antiligante/2
O.L. = 2-0/2
O.L. = 1
II - CORRETO
III - CORRETO
Não fazia parte do conteúdo no edital!
Esse KK é resenha kkkk
"KK" RINDO DOS CONCURSEIROS.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo