Questões Militares
Comentadas sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 32 questões
Uma das aplicações da trinitroglicerina, cuja fórmula é C3H3N3O9, é a confecção de explosivos. Sua decomposição enérgica gera como produtos os gases nitrogênio, dióxido de carbono e oxigênio, além de água, conforme mostra a equação da reação a seguir:
4 C3H3N3O9 (l) → 6 N2 (g) + 12 CO2 (g) + 1 O2 (g) + 10 H2O (l).
Além de explosivo, a trinitroglicerina também é utilizada como princípio ativo de medicamentos no tratamento de angina, uma doença que acomete o coração. Medicamentos usados no tratamento da angina usam uma dose padrão de 0,6 mg de trinitroglicerina na formulação. Considerando os dados termoquímicos da reação a 25 ºC e 1 atm e supondo que essa massa de trinitroglicerina sofra uma reação de decomposição completa, a energia liberada seria aproximadamente de
Dados: massas atômicas: C = 12 u; H = 1 u; N = 14 u; O = 16 u.
∆Hof (H2O) = - 286 kJ/mol; ∆Hof
(CO2) = - 394 kJ/mol; ∆Hof
(C3H5N3O9) = - 353,6 kJ/mol
O propan-2-ol (álcool isopropílico), cuja fórmula é C3H8O, é vendido comercialmente como álcool de massagem ou de limpeza de telas e de monitores. Considerando uma reação de combustão completa com rendimento de 100% e os dados de entalpias padrão de formação (∆Hof ) das espécies participantes desse processo e da densidade do álcool, a quantidade de energia liberada na combustão completa de 10,0 L desse álcool será de

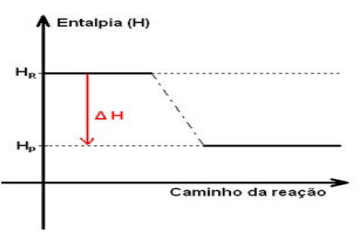
De acordo com o gráfico acima pode concluir se que trata se de uma reação Hp = 250, Hr = 480: I - Espontânea. II - Exotérmica, pois ocorreu um ganho de energia. III - Necessita apenas de um estímulo para que ocorra. IV - Sendo o Hp = 250 kj e Hr = 480kj o delta será de +130 kj. V - Endotérmica, pois ocorreu uma perda de energia. VI - Sendo o Hp = 250 e Hr = 480 delta H será de -130kj. Estão incorretas:
As equações químicas a seguir representam o processo de síntese dos óxidos de bário e alumínio e suas respectivas entalpias de transformação.
2Ba(s) + O2 (g) → 2 BaO(s) ΔHº = –1.107 kJ
2Al(s) + 3/2O2 (g) → Al2 O3 (s) ΔHº = –1.676 kJ
O metal bário é produzido pela reação do metal alumínio com óxido de bário.
A partir dessas informações, a variação da entalpia para a reação de produção do metal bário é igual a:
Dados: massas atômicas: C = 12 u ; O = 16 u ; H = 1 u
A análise dos dados termodinâmicos de reações permite a previsão da espontaneidade. Na tabela a seguir estão apresentados os dados termodinâmicos de duas reações químicas.
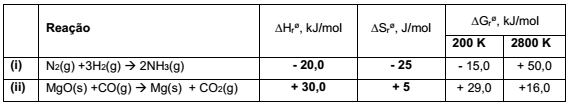
A partir dos dados apresentados, identifique as seguintes afirmativas como verdadeiras (V) ou falsas (F):
( ) A diminuição da temperatura desfavorece a espontaneidade da reação (i).
( ) O aumento da temperatura favorece a espontaneidade da reação (ii).
( ) Na temperatura de 400 K, a reação (i) será espontânea.
( ) Na temperatura de 4000 K, a reação (ii) será espontânea.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
O texto a seguir serve como base para a resolução da questão.
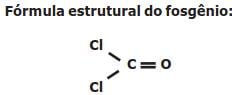
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a
Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro
preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro
(Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2 (g) COCl2 (g).
Dados:
Energia de Ligação
C = O 745 kJ/mol
C
 O 1080 kJ/mol
O 1080 kJ/mol C - Cl 328 kJ/mol
Cl - Cl 243 kJ/mol

Com base nessas informações e considerando
 a variação de
a variação deentalpia padrão das reações a 25 ºC, julgue os itens a seguir.
Dos combustíveis citados na tabela, o hidrogênio apresenta o maior poder calorífico por mol de combustível queimado.
Sendo o metilpropano isômero do butano, esses dois hidrocarbonetos, nas mesmas condições experimentais, apresentam o mesmo poder calorífico.
Considerando-se que o rendimento da reação completa de combustão do butano seja de 100%, é correto afirmar que, para a queima completa de 116 g desse hidrocarboneto, seria necessária massa mínima de oxigênio superior a 410 g.

