Questões Militares
Comentadas sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 32 questões
2 H2 S(g) + 3 O2 (g) → 2 SO2 (g) + 2 H2 O(g)
A tabela reúne as entalpias de formação dos componentes da reação.

Portanto, a entalpia da reação, em kJ.mol–1 de H2 S(g), é, aproximadamente,
A reação da amônia com oxigênio pode ocorrer sob condições adequadas, de acordo com a equação a seguir.
Equação 1
2 NH3(g) + 3/2 O2(g) → N2(g) + 3 H2O(g)
Considere as seguintes equações termoquímicas envolvendo a amônia:
2 NH3(g) + 7/2 O2(g) → 2 NO2(g) + 3 H2O(g) ΔHo = –566 kJ
3 NO2(g) + 4 NH3(g) → 7/2 N2(g) + 6 H2O(g) ΔHo = –1370 kJ
A entalpia da reação da combustão de um mol de amônia representada na equação 1 é igual a, aproximadamente
Dados: fórmulas moleculares: metano: CH4; propano: C3H8; butano: C4H10; etanol: C2H6O; e metanol: CH4O.
Considerando a reação de combustão completa desses combustíveis, o que necessitará de maior quantidade de gás oxigênio por molécula de combustível é o
O gás propano, um dos componentes do gás de cozinha, pode ser preparado pela reação entre carvão — C(s) — e hidrogênio gasoso — H2(g).
C3H8(g) + 5 O2(g) → 3 CO2(g) + 4 H2O(l) ΔH° = −2.220 kJ
C(s) + O2(g) → CO2(g) ΔH° = −394 kJ
H2(g) + ½ O2(g) → H2O(l) ΔH° = −286 kJ
Com base nos calores de formação fornecidos, e sabendo-se que
M(H) = 1 g/mol, M(C) = 12 g/mol e M(O) = 16 g/mol, é correto
concluir que o módulo da variação de entalpia (ΔH1g) obtida na
preparação de 1 g de propano pelo processo citado, nas
condições padrão, é tal que
Com os problemas de natureza sanitária causados pela pandemia gerada pela Covid-19, o Corpo de Bombeiros Militar de Minas Gerais tem realizado ações que visam orientar a população quanto ao uso do álcool em gel 70 ºINPM (grau INPM – Instituto Nacional de Pesos e Medidas) ou (70% p/p). O fato é que o álcool em gel se tornou um poderoso combatente no processo de higienização das mãos e proteção contra o novo coronavírus. Entretanto, não se deve nos esquecer de que, além de um eficiente desinfetante, o álcool é uma substância inflamável. Ele também tem sido a causa de muitos acidentes domésticos devido ao seu uso inadequado.
A equação a seguir representa a combustão de um mol de molécula do etanol:
CH3CH2OH + 3O2 → 2 CO2 + 3 H2O
ΔH° = - 1373kJ
O etanol é o tipo de álcool utilizado no álcool em gel.
Se considerar apenas o álcool 70 ºINPM como
constituinte do álcool em gel e que 460 g desse composto
foram completamente queimados, qual a energia, em kJ,
mais próxima liberada nesse processo?
O etanol, utilizado como combustível em carros flex, é produzido pelo processo de fermentação, do caldo de cana, “garapa”, onde leveduras transformam a sacarose em álcool, segundo a reação simplificada:
C12H22O11 + H2O → 2C6 H12O6
C6H12O6 → CH3CH2OH + 2CO2
∆H = -23,5kcal
A fermentação da sacarose trata-se de um
processo:
Sobre a fumaça que anuncia a escolha do papa, assinale a alternativa correta:

Assinale a alternativa que completa, correta e respectivamente, as lacunas.
Analise o diagrama.
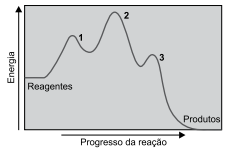
O diagrama representa uma reação _______________ , que ocorre em três etapas, sendo a mais ____________ a etapa 3, porque possui ____________ energia de ativação.
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
I. A parafina da vela é constituída por moléculas de fórmula molecular CxHy, em que x < 8. II. A combustão da parafina na vela tem como principais produtos: negro de fumo, monóxido de carbono, dióxido de carbono e água. III. cor amarela da parte superior da chama indica um processo de combustão que depende da difusão do oxigênio presente no ar. IV. Na região inferior da chama há coloração levemente azulada por conta da maior quantidade de oxigênio difundido pelas zonas de recirculação.
Das afirmações acima, está(ão) CORRETA(S)
C6H12O6(s) + 602(g) → 6CO2(g) + 6 H2O (l) ∆H0 combustão = – 2800 kj/mol
Considere os seguintes dados de massa molar em g/mol:
C=12, H=1, O=16
Com base nas informações do enunciado, assinale a alternativa que apresenta a energia obtida e a quantidade de CO2 liberada na oxidação de 18 g (gramas) de glicose.
Devido ao intenso calor liberado, reações de termita são bastante utilizadas em aplicações militares como granadas incendiárias ou em atividades civis como solda de trilhos de trem. A reação de termita mais comum é a aluminotérmica, que utiliza como reagentes o alumínio metálico e o óxido de ferro III.
A reação de termita aluminotérmica pode ser representada pela equação química não balanceada:
Al (s) + Fe2O3 (s) → Fe (s) + Al2O3 (s) + Calor
Dados: valores arredondados de entalpias padrão de formação das espécies ∆Ho fAl2O3 = - 1676 kJ/ mol; ∆Ho f Fe2O3 = - 826 kJ/mol
Acerca desse processo, são feitas as seguintes afirmativas:
I – Após correto balanceamento, o coeficiente do reagente alumínio na equação química é 2.
II – Essa é uma reação de oxidorredução e o agente oxidante é o óxido de ferro III.
III – Na condição padrão, o ∆H da reação é - 503 kJ para cada mol de óxido de alumínio produzido.
IV – Na condição padrão, para a obtenção de 56 g de ferro metálico, o calor liberado na reação é de 355 kJ.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.

I – O agente oxidante dessa reação é o O2.
II – O coeficiente estequiométrico da água, após o balanceamento da equação, é 2.
III – Considerando a densidade do etanol 0,8 g/mL (25 ºC; 1 atm), a combustão completa de 1150 mL desse composto libera aproximadamente 27360 kJ.
IV – A quantidade de calor liberada na combustão de 1 mol de etanol é de 278 kJ·mol-1.
Das afirmativas feitas estão corretas apenas
O trioxano, cuja fórmula estrutural plana simplificada encontra-se representada a seguir, é utilizado em alguns países como combustível sólido para o aquecimento de alimentos armazenados em embalagens especiais e que fazem parte das rações operacionais militares.
Considere a reação de combustão completa de um tablete de 90 g do trioxano com a formação de CO2 e H2O. Baseado nas energias de ligação fornecidas na tabela abaixo, o valor da entalpia de combustão estimada para esta reação é
Dados:
Massas Atômicas: O=16 u ; H = 1 u ; C=12 u.

Algumas viaturas militares administrativas possuem motores à combustão que utilizam como combustível a gasolina. A queima (combustão) de combustíveis como a gasolina, nos motores à combustão, fornece a energia essencial para o funcionamento dessas viaturas militares. Considerando uma gasolina na condição padrão (25 °C e 1 atm), composta apenas por n-octano (C8H18) e que a sua combustão seja completa (formação exclusiva de CO2 e H2O gasosos como produtos), são feitas as seguintes afirmativas:
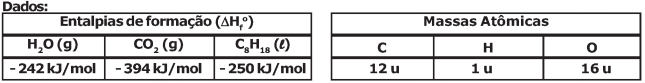
I - a combustão da gasolina (C8H18) é uma reação exotérmica;
II - na combustão completa de 1 mol de gasolina, são liberados 16 mols de gás carbônico (CO2);
III - a entalpia de combustão (calor de combustão) dessa gasolina é - 5080 kJ/mol (ΔHc=-5080 kJ/mol);
IV - o calor liberado na combustão de 57 g de gasolina é de 1270 kJ.
Das afirmativas apresentadas estão corretas apenas a