Questões Militares
Sobre transformações químicas e energia em química
Foram encontradas 361 questões
Em um acidente com um tanque industrial, houve combustão completa de 200 L de hexano, hidrocarboneto empregado como solvente. Sabe-se que a densidade dessa substância é de 655 g/L.
Nessa combustão, o volume de gás oxigênio consumido nas CNTP, em litros, corresponde aproximadamente a:
II. Dado que os valores de potencial padrão do eletrodo de cobre e do calomelano saturado em relação ao eletrodo padrão de hidrogênio são, respectivamente, 0,34 V e 0,24 V, o potencial do eletrodo de cobre em relação ao eletrodo de calomelano saturado será 0,10 V.
III. Os potenciais padrão de eletrodo não são valores absolutos de semicélulas, mas sim diferenças de potencial entre semicélulas.
IV. O catodo de uma célula galvânica torna-se o anodo quando essa célula passa a operar como célula eletrolítica, embora a redução sempre ocorra no catodo da célula e a oxidação sempre ocorra no anodo.
Assinale a opção que contém as afirmações CORRETAS.
II. Em uma mistura de octano e oxigênio, o combustível representa aproximadamente 78% da massa total.
III. A variação de temperatura da reação de combustível e oxigênio (por mol de combustível) é igual à variação de temperatura da reação de combustível e ar atmosférico (por mol de combustível).
IV. A entalpia molar de combustão de uma mistura de combustível e oxigênio é igual à entalpia molar de combustão de uma mistura de combustível e ar atmosférico. Assinale a opção que contém as afirmações CORRETAS.
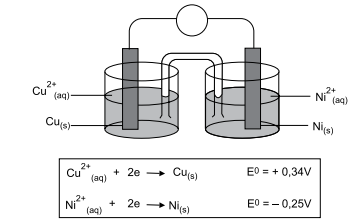
Considerando a constante de Faraday igual a 9,65 × 104 C.mol–1 , a energia livre de Gibbs para essa pilha é
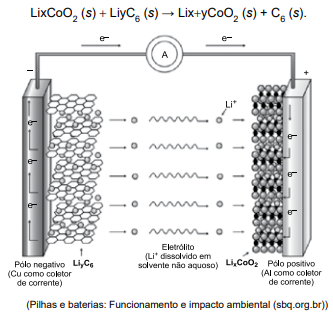
De acordo com o esquema, durante a descarga da bateria
MnO4 – (aq) + H2 O2 (aq) + H+ (aq) → Mn2+ (aq) + O2 (g) + H2 O(l)
Considerando as semirreações e seus potenciais de redução, a 25 ºC,
O2 + 2 H+ + 2 e– → H2 O2 ; E0 = + 0,68 V MnO4 – (aq) + 8 H+ (aq) + 5 e– → Mn2+(aq) + 4 H2 O(l); E0 = +1,51 V
conclui-se que o potencial da reação global e os coeficientes estequiométricos menores e inteiros que completam a equação são:
2 H2 S(g) + 3 O2 (g) → 2 SO2 (g) + 2 H2 O(g)
A tabela reúne as entalpias de formação dos componentes da reação.

Portanto, a entalpia da reação, em kJ.mol–1 de H2 S(g), é, aproximadamente,
Na + CH3 CH2 OH → CH3 CH2 ONa + H2
Considerando que nas CATP (Condições Ambientais de Temperatura e Pressão) 1 mol de qualquer gás ocupa 25 L, o volume de H2 produzido, quando reagem 1 g de sódio e 1 g etanol, e a massa do excesso de reagente são, respectivamente,
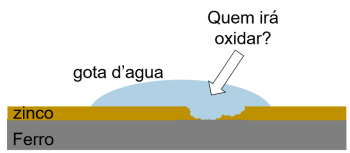
Considerando a imagem e os valores de E°red fornecidos, é CORRETO afirmar que a substância que sofrerá oxidação será:
A respeito da reação de oxirredução balanceada apresentada anteriormente, é correto afirmar que
C5H8N4O12 (s) → 4 H2O (g) + 3 CO2 (g) + 2 N2 (g) + 2 CO (g)
As entalpias padrão de formação (
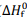 ), a 1 atm e 298 K,
são informadas na tabela a seguir.
), a 1 atm e 298 K,
são informadas na tabela a seguir. 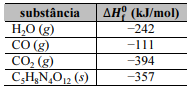
A partir desses dados, é correto concluir que a variação de entalpia para a reação de detonação de PETN, a 1 atm e 298 K, é
P. Atkins e L. Jones. Princípios de Química: questionando a vida moderna e o meio ambiente. 7.ª ed. Bookman Companhia, 2018, p. 654.
No contexto a que se refere o fragmento de texto anterior, a energia vibracional é
Mg2+ + 2e–→ Mg0 E°red= –2,37 V Fe2+ + 2e–→ Fe0 E°red= –0,44 V
A partir das informações apresentadas, assinale a afirmativa correta.
É possível que algum candidato tenha na bolsa uma barra de chocolate, ou até mesmo balas, como fonte de nutriente. Nosso organismo, heterotrófico, precisa da glicose (C6H12O6) proveniente da alimentação para sobreviver e o hormônio da insulina deve estar presente, para permitir a entrada do carboidrato nas células. Uma empresa de táxi situada no centro da cidade convocou o corpo de bombeiros e o SAMU (Serviço de Atendimento Móvel de Urgência) para o resgate de um jovem de 315 kg que, devido a um mal súbito com desmaio, ficou preso entre os bancos de um dos automóveis da frota e não conseguia levantar-se sozinho. Após a análise médica e estabilização do paciente, foi constatado um quadro de hipoglicemia. Se o nível de glicose do paciente for de 43 mg/dL (considere 1dL = 0,1 L), a conversão desta unidade de concentração em mmol/L de glicose resultará no valor aproximado de:
(Dados de massas molares: C = 12,0 g/mol; O = 16,0 g/mol; e, H = 1,0 g/mol.)
Al0 + 3Ag+ → Al3+ + 3Ag0
A partir desta observação da pilha acima representada pela equação, assinale a alternativa correta.