Questões Militares
Sobre transformações químicas e energia em química
Foram encontradas 365 questões
Mg2+ + 2e–→ Mg0 E°red= –2,37 V Fe2+ + 2e–→ Fe0 E°red= –0,44 V
A partir das informações apresentadas, assinale a afirmativa correta.
É possível que algum candidato tenha na bolsa uma barra de chocolate, ou até mesmo balas, como fonte de nutriente. Nosso organismo, heterotrófico, precisa da glicose (C6H12O6) proveniente da alimentação para sobreviver e o hormônio da insulina deve estar presente, para permitir a entrada do carboidrato nas células. Uma empresa de táxi situada no centro da cidade convocou o corpo de bombeiros e o SAMU (Serviço de Atendimento Móvel de Urgência) para o resgate de um jovem de 315 kg que, devido a um mal súbito com desmaio, ficou preso entre os bancos de um dos automóveis da frota e não conseguia levantar-se sozinho. Após a análise médica e estabilização do paciente, foi constatado um quadro de hipoglicemia. Se o nível de glicose do paciente for de 43 mg/dL (considere 1dL = 0,1 L), a conversão desta unidade de concentração em mmol/L de glicose resultará no valor aproximado de:
(Dados de massas molares: C = 12,0 g/mol; O = 16,0 g/mol; e, H = 1,0 g/mol.)
Al0 + 3Ag+ → Al3+ + 3Ag0
A partir desta observação da pilha acima representada pela equação, assinale a alternativa correta.
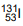 radioativo foi empregado pela primeira vez em 1941 no Massachusetts General Hospital, quando Hertz e Roberts trataram pacientes com hipertireoidismo. Dependendo da dose de iodo radioativo administrada, pode ser necessária a internação do
paciente, geralmente em um quarto especial para impedir que outras pessoas sejam expostas à radiação. O isótopo
radioativo foi empregado pela primeira vez em 1941 no Massachusetts General Hospital, quando Hertz e Roberts trataram pacientes com hipertireoidismo. Dependendo da dose de iodo radioativo administrada, pode ser necessária a internação do
paciente, geralmente em um quarto especial para impedir que outras pessoas sejam expostas à radiação. O isótopo 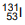 possui
possui 
Cu2+(aq) + 2
Foi adicionada a uma bomba calorimétrica selada, com volume invariável a 25 ºC, uma mistura gasosa de um hidrocarboneto saturado e oxigênio, com pressão total P1 , em proporção estequiométrica para reação de combustão completa.
Após acionada a ignição, a mistura gasosa reagiu completamente. Considerando que o volume do líquido formado na reação é desprezível em relação ao volume total do compartimento e que a pressão P2 no interior da bomba calorimétrica após a reação 25 ºC é igual a 0,5 x P1 , a fórmula molecular do hidrocarboneto empregado no experimento é:
Considere as seguintes representações de equações de reação:
I. A (g) + B (g) → AB (s) ΔHo > 0
II. C (l) + D (s) → CD (g) ΔHo > 0
A respeito da espontaneidade dessas reações, é correto afirmar que
A reação da amônia com oxigênio pode ocorrer sob condições adequadas, de acordo com a equação a seguir.
Equação 1
2 NH3(g) + 3/2 O2(g) → N2(g) + 3 H2O(g)
Considere as seguintes equações termoquímicas envolvendo a amônia:
2 NH3(g) + 7/2 O2(g) → 2 NO2(g) + 3 H2O(g) ΔHo = –566 kJ
3 NO2(g) + 4 NH3(g) → 7/2 N2(g) + 6 H2O(g) ΔHo = –1370 kJ
A entalpia da reação da combustão de um mol de amônia representada na equação 1 é igual a, aproximadamente
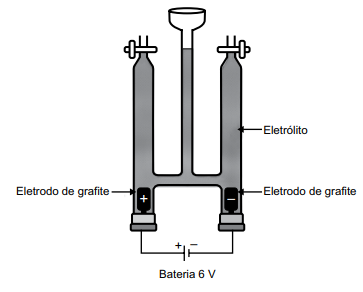
Em uma aula prática de química, foi montada a aparelhagem representada na figura a seguir, para um experimento de eletrólise, usando-se como eletrólito, uma solução aquosa de iodeto de sódio 1,0 mol/L em pH = 7 e algumas gotas de uma solução aquosa de amido.
Dados: potencial padrão de redução a 25 ºC.
O2(g) + H2O(l) + 4e–
→ 4OH–(aq) Eo
= +0,40 V
I2(s) + 2 e– → 2 I– (aq) Eo = +0,54 V
O2(g) + 4 H+(aq) + 4e– → 2 H2O(l) Eo = +1,23 V
2 H2O (l) + 2e– → H2(g) + 2OH– (aq) Eo = –0,83 V
Na+(aq) + 1e– → Na(s) Eo = –2,71 V
(P. Atkins, P.; L. Jones; Princípios de Química: questionando a vida
moderna e o meio ambiente. 5ª ed. Porto Alegre: Bookman, 2012)
Ao iniciar o experimento, verificou-se o sugimento de
coloração azulada em um dos compartimentos eletródicos e a formação de um gás no outro compartimento.
Esse fato ocorreu devido à formação de iodo no
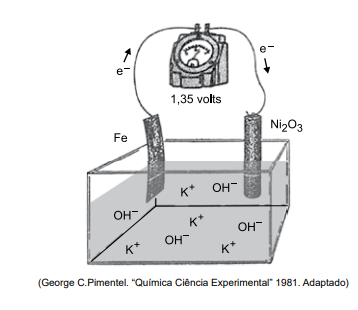
A bateria de Thomas Edison desenvolvida no século 19 é um dispositivo eletroquímico que funciona de acordo com o esquema simplificado representado na figura. No sentido da descarga, o potencial fornecido por par de eletrodos é igual a +1,35V
Considere as informações:
Semirreação Potencial padrão de redução (Eº)
I. Fe(OH)2 (s) + 2e– → Fe(s) + 2OH– (aq) X
II. Ni2O3(s) + 3H2O (l) + 2e– → 2Ni(OH)2(s) + 2OH–
(aq) +0,48V
Na bateria de Thomas Edison em operação no sentido da descarga, o eletrodo em que se processam a oxidação e o
potencial padrão de redução da equação I são:
Uma solução aquosa de cianeto de sódio foi adicionada a uma solução aquosa de permanganato de potássio, em meio básico. Assim, foram formados o óxido de manganês (IV) sólido e o íon cianato, CNO– .
Na semirreação envolvendo um mol do íon cianeto há a participação de ________ elétrons.
No balanceamento da equação global da reação envolvendo 2 mol do íon permanganato, participam _______ de íons hidroxila representados no lado dos _______ da equação de reação.
Assinale a alternativa que preenche, correta e respectivamente, as lacunas do texto.
A figura apresenta um diagrama de temperatura-composição de um azeótropo de ponto de ebulição mínimo.
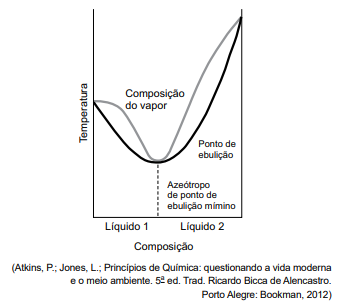
Esse diagrama refere-se a uma mistura de líquidos, tal
como
a KMnO4 + b FeSO4 + c H2SO4 → d Fe2(SO4)3 + e K2SO4 + f MnSO4 + g H2O
A soma dos coeficientes estequiométricos (a + b + c + d + e + f + g) que tornam a equação balanceada é igual a

Considerando as informações apresentadas, os agentes oxidantes que corroerão somente o chumbo das peças são:
O ferro é um elemento de ampla utilização pela indústria, como a produção de ligas metálicas, de automóveis e de diversos utensílios domésticos e industriais. Esse metal pode ser obtido através de uma reação de oxirredução entre a magnetita e o monóxido de carbono, conforme representado nas equações abaixo:
I Fe3O4 + 3CO → 3FeO + 3CO2
II FeO + CO → Fe + CO2
Acerca das reações apresentadas, assinale a alternativa correta.