Questões Militares
Sobre transformações químicas e energia em química
Foram encontradas 370 questões
Observe a tabela abaixo:

O valor da entalpia-padrão de combustão do benzeno liquido a partir das entalpias de formação dos reagentes e produtos da reação, conforme tabela acima, considerando uma combustão completa, é:
Dado: reação de combustão do benzeno:
C6H6 (l) + 15/2 O2(g) → 6CO2(g) + 3H2O(I)
O decaimento do trício, um isótopo radioativo do hidrogênio empregado em pesquisas com reatores nucleares de fusão e em armas termonucleares, está representado no gráfico a seguir.
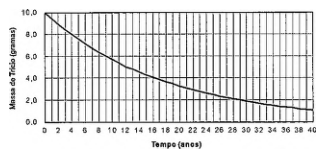
Uma amostra de trício apresenta uma atividade radioativa inicial de 3,0x109 desintegrações por segundo. Com base nos dados e no gráfico acima, pode-se prever que essa amostra apresentará uma atividade de 7,5x108 desintegrações por segundo após, aproximadamente:
Dados:
In(2) = 0,69 ln(3) = 1,1 ln(4) = 1,4
In (6) = 1,8 ln(7,5) = 2,0
Considerando a classificação das formas de corrosão segundo a sua morfologia, correlacione os termos técnicos a suas definições e assinale a opção que apresenta a sequência correta.
TERMOS TÉCNICOS
I- Intergranular
II- Dezincificação
III- Empolamento pelo hidrogênio
IV- Transgranular
V- Filiforme
DEFINIÇÕES
( ) A corrosão se processa nos grãos da rede cristalina do material metálico, o qual, perdendo suas propriedades mecânicas, poderá fraturar à menor solicitação mecânica.
( ) É a corrosão que ocorre em ligas de latão, em que se observa o aparecimento de regiões de coloração avermelhada, contrastando com a característica coloração amarela dos latões.
( ) A corrosão se processa entre os grãos da rede
cristalina do material metálico, o qual perde suas
propriedades mecânicas e pode fraturar quando
solicitado por esforços mecânicos.
( ) A corrosão se processa sob a forma de finos filamentos, mas não profundos, que se propagam em diferentes direções e que não se ultrapassam, pois admite-se que o produto de corrosão, em estado coloidal, apresente carga positiva, daí a repulsão.
( ) Corrosão que ocorre quando o hidrogênio atômico penetra no metal e difunde-se rapidamente para regiões com descontinuidades, onde se transforma em hidrogênio molecular, exercendo pressão e originando a formação de bolhas.
O urânio-235 (235U) é utilizado como combustível em diversos tipos de reatores nucleares de fissão para a produção de energia elétrica, sendo esses reatores projetados para induzir e sustentar uma reação nuclear em cadeia lenta e controlada. A equação 1 ilustra uma das possíveis reações nucleares de fissão induzida que ocorrem com o 235U, enquanto que a equação 2 ilustra a reação de decaimento nuclear do antimônio-131 (131Sb), um dos diversos produtos gerados pela fissão do 235U, até a formação de um núcleo estável de xenônio-131 (131Xe).
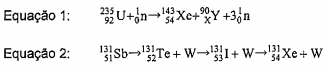
Nas equações acima, X, Y, W e o tipo de decaimento
nuclear ilustrado na equação 2 são, respectivamente:
O calorímetro é utilizado no laboratório para inúmeros propósitos, incluindo a determinação da energia produzida na queima de combustíveis e o conteúdo calórico dos alimentos. Numa bomba calorimétrica, assume-se que a quantidade de calor absorvido (ou liberado) pela combinação de água, o interior do calorímetro, a bomba e a mistura reagente seja igual à produzida (ou absorvida) pela reação que ocorre na bomba. Considerando que uma amostra de 0,728 g de etanol (álcool de cereais, C2H5OH) é queimada numa bomba calorimétrica com uma quantidade de gás oxigênio (sob pressão) suficiente para assegurar a combustão completa, qual é o calor molar de combustão do etanol, sabendo que, nesse experimento, a quantidade de água no calorímetro é de 1,20 kg e que a temperatura aumenta de 24,86°C para 29,18°C?
Dados: capacidade calorífica do interior do calorímetro (sem água) é de 1,06 kJ °C-1 e a capacidade calorífica molar da água é 75,3 J °C-1 mol-1.
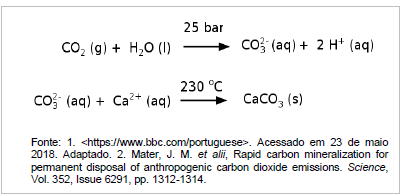
A remoção desse gás da atmosfera ocorre por:

I – O agente oxidante dessa reação é o O2.
II – O coeficiente estequiométrico da água, após o balanceamento da equação, é 2.
III – Considerando a densidade do etanol 0,8 g/mL (25 ºC; 1 atm), a combustão completa de 1150 mL desse composto libera aproximadamente 27360 kJ.
IV – A quantidade de calor liberada na combustão de 1 mol de etanol é de 278 kJ·mol-1.
Das afirmativas feitas estão corretas apenas
Dados: massa molar do cobre = 64 g · mol-1 ; 1 Faraday = 96500 C · mol-1
A seguir, são apresentadas algumas semi-reações de redução e seus respectivos potenciais-padrão.
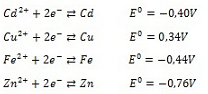
FONTE: ATKINS, P.; PAULA, J. Atkins Físico Química. 7 ed. Rio de Janeiro: LTC, 2003. v. 1. p. 336.
A partir dessas semi-reações, pode-se afirmar que
O etanoi é um combustível obtido a partir de fontes renováveis, e cuja equação de combustão a 25°C é a seguinte:
C2H5OH(I) + 3O2(g) → 2CO2(g) + 3H2O(I) ΔH298 =-1368 kJ/mol
Sabendo-se que um volume de 8,05 litros de etanol foi queimado, a quantidade total de calor liberado, em kJ, na combustão acima é:
Dado: densidade do etanoi = 0,8 g/cm3
Considere as seguintes equações termoquímicas:
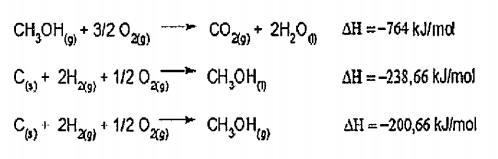
A entalpia de combustão para o metanol líquido, em
kJ/mol, é:
Calcule a f.e.m. de uma célula formada pela imersão de uma lâmina de cobre numa solução de 0,15M de CuSO4 e um bastão de zinco numa solução de 0,25M de ZnSO4 e marque a opção correta.
Dados:
Equação de Nernst: E = E0 + (0,0592/n) x log M
Cu2+ + 2e- = Cu; E0Cu = 0,34V
Zn2+ + 2e- = Zn; E0Zn = -0,76V
log(0,15) = -0,82391
log(0,25) = -0,60206
Analise os potenciais padrão dos eletrodos de prata e zinco abaixo.
Ag+ + e- ↔ Ag E° = + 0,7999 V
Zn2+ + 2e- ↔ Zn E° = - 0,763 V
Assinale a opção que apresenta a reação da pilha dos
potenciais padrão acima.
Calcule o potencial da célula Zn|ZnSO4||CuSO4|Cu e indique se a reação Zn(s)+ Cu2+ -> Zn2+ + Cu(s) ocorre de forma espontânea ou não, marcando a opção correta.
Dados: E0Cu = +0,337V; E0Zn = -0.763V
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1
