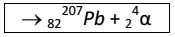Questões Militares
Sobre transformações químicas e energia em química
Foram encontradas 365 questões
"À medida que ocorre a emissão de partículas do núcleo de um elemento radioativo, ele está se desintegrando. A velocidade de desintegrações por unidade de tempo é denominada velocidade de desintegração radioativa, que é proporcional ao número de núcleos radioativos. O tempo decorrido para que o número de núcleos radioativos se reduza à metade é denominado meia-vida."
USBERCO, João e SALVADOR, Edgard. Química. 12ª ed. Reform - São Paulo: Editora Saraiva, 2009. (Volume 2: Físico-Química).
Utilizado em exames de tomografia, o radioisótopo flúor-18 (18F) possui meia-vida de uma hora e trinta minutos (1 h 30 min). Considerando-se uma massa inicial de 20 g desse radioisótopo, o tempo decorrido para que essa massa de radioisótopo flúor-18 fique reduzida a 1,25 g é de
Dados: log 16 = 1,20; log 2 = 0,30
Células galvânicas (pilhas) são dispositivos nos quais reações espontâneas de oxidorredução geram uma corrente elétrica. São dispostas pela combinação de espécies químicas com potenciais de redução diferentes. Existem milhares de células galvânicas possíveis. Considere as semirreações abaixo e seus respectivos potenciais de redução nas condições padrão (25 °C e 1 atm).
Al3+ (aq) + 3 e- → Al (s) ΔE°red = -1,66 V
Au3+ (aq) + 3 e- → Au (s) ΔE°red = +1,50 V
Cu2+ (aq) + 2 e- → Cu (s) ΔE°red = +0,34 V
Baseado nas possibilidades de combinações de células galvânicas e suas representações esquemáticas recomendadas pela União Internacional de Química Pura e Aplicada (IUPAC), são feitas as seguintes afirmativas:
I - a diferença de potencial (d.d.p.) da pilha formada pelas espécies químicas alumínio e cobre e representada esquematicamente por Al(s)|Al3+(aq)||Cu2+ (aq) |Cu (s) é de +1,52 V (nas condições-padrão);
II - na pilha formada pelas espécies químicas cobre e ouro e representada esquematicamente por Cu (s) |Cu2+(aq) || Au3+(aq) |Au (s), a reação global corretamente balanceada é:
3 Cu (s) + 2 Au3+ (aq) → 3 Cu2+ (aq) + 2 Au (s)
III - na pilha formada pelas espécies químicas cobre e ouro e representada esquematicamente por Cu (s) | Cu2+(aq) || Au3+ (aq) | Au (s), o agente redutor é o Cu (s);
IV - a representação IUPAC correta de uma pilha de alumínio e ouro (Al-Au) é Au (s) | Au3+(aq) || Al3+(aq) | Al (s).
Estão corretas apenas as afirmativas
O trioxano, cuja fórmula estrutural plana simplificada encontra-se representada a seguir, é utilizado em alguns países como combustível sólido para o aquecimento de alimentos armazenados em embalagens especiais e que fazem parte das rações operacionais militares.
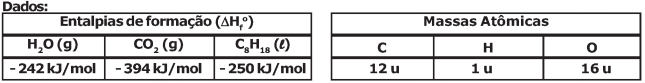
Considere a reação de combustão completa de um tablete de 90 g do trioxano com a formação de CO2 e H2O. Baseado nas energias de ligação fornecidas na tabela abaixo, o valor da entalpia de combustão estimada para esta reação é
Dados:
Massas Atômicas: O=16 u ; H = 1 u ; C=12 u.

Algumas viaturas militares administrativas possuem motores à combustão que utilizam como combustível a gasolina. A queima (combustão) de combustíveis como a gasolina, nos motores à combustão, fornece a energia essencial para o funcionamento dessas viaturas militares. Considerando uma gasolina na condição padrão (25 °C e 1 atm), composta apenas por n-octano (C8H18) e que a sua combustão seja completa (formação exclusiva de CO2 e H2O gasosos como produtos), são feitas as seguintes afirmativas:
I - a combustão da gasolina (C8H18) é uma reação exotérmica;
II - na combustão completa de 1 mol de gasolina, são liberados 16 mols de gás carbônico (CO2);
III - a entalpia de combustão (calor de combustão) dessa gasolina é - 5080 kJ/mol (ΔHc=-5080 kJ/mol);
IV - o calor liberado na combustão de 57 g de gasolina é de 1270 kJ.
Das afirmativas apresentadas estão corretas apenas a
“Um banho de ouro consiste em mergulhar o metal-base em uma solução de sais de ouro e ligá-lo à corrente elétrica. Ao lado dele, mergulha-se uma barra de ouro ligada ao outro polo de corrente elétrica, que tem, nessas condições, a propriedade de transportar o ouro líquido e depositá-lo sobre a peça a ser dourada. O banho de ouro pode ser aplicado em diversos tipos de metal-base, como: prata, níquel, cobre e latão. Dependendo do tempo de duração da imersão da peça, essa camada poderá ser mais ou menos espessa. A boa douração tem espessura na ordem de 0,02 mm ou 20 mícrons.”
(Disponível em: https://agatarp.com.br/blog/2012/08/31/a-diferenca-entre-folheamento-e-o-banho-de-ouro/.)
Assinale a alternativa que corresponde ao número de mols de ouro utilizado em uma eletrodeposição de Au+ que durou 7 minutos e utilizou 4,6 A.
(Dados: massa molar do Au = 197g; 1F = 96500C; 1A = 1C/s.)
Analise as afirmativas a seguir.
I. Quanto maior o potencial de redução, maior o poder da espécie química de se reduzir.
II. Em uma reação química de oxidação-redução espontânea, o melhor oxidante reage com o melhor redutor.
III. Em uma reação espontânea, a variação do potencial é sempre em módulo.
IV. A equação da oxidação-redução que ocorre para o eletrodo de hidrogênio pode ser escrita como semirreação de redução ou semirreação de oxidação.
Estão corretas as afirmativas
A Equação de Nernst, desenvolvida pelo químico e físico alemão Walther Hermann Nernst, é a relação quantitativa que permite calcular a força eletromotriz de uma pilha para concentrações de íons diferentes de uma unidade. Também é usada para cálculos em titulação de oxidação-redução.
A equação a 25°C pode ser escrita de forma reduzida como: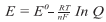
Sendo: R = 8,315 J K-1 mol-1; T = 298,2 K (25°C); F = 96485 C mol-1
Calcule a força eletromotriz para a seguinte pilha a 25°C: Fe / Fe2 + (0,02M) || Cu2
+(0,2M) / Cu
Dados: potencial padrão de redução (Eº Fe = -0,44V e Eº Cu = +0,40V).
Corrosão é a destruição ou deterioração de um material devido à reação química ou eletroquímica com seu meio. A corrosão é a transformação de um material pela sua interação química ou eletroquímica com o meio.
Sobre os exemplos de métodos de combate à corrosão, é incorreto afirmar que
Inibidor de corrosão é uma substância ou mistura de substâncias que, quando presente em concentrações adequadas, no meio corrosivo, reduz ou elimina a corrosão. As seguintes afirmativas referem-se ao inibidor de corrosão.
I. Inibidores protetivos emulsionáveis em água deixam por evaporação uma película oleosa aplicada por diluição em água.
II. O método de proteção usando protetivos temporários é baseado na obtenção de uma película superficial, fácil de aplicar e remover.
III. Inibidores catódicos têm a capacidade de formar películas sobre as áreas anódicas e catódicas, interferindo com a ação eletroquímica.
IV. Inibidores anódicos atuam favorecendo as reações anódicas, protegendo o cátodo da corrosão. São eficazes, mesmos em pequenas concentrações.
Está correto apenas o que se afirma em
Analise as afirmativas acerca das equações termoquímicas descritas por Masterton (2010).
I. O valor em módulo ΔH é diretamente proporcional às quantidades dos reagentes ou dos produtos.
II. O valor de ΔH para uma reação é igual ao de seu valor em reação inversa.
III. O valor de ΔH para uma reação é o mesmo independente se ela ocorra em uma ou em uma série de etapas.
Estão corretas as afirmativas
Acerca da radioatividade, analise as afirmativas a seguir:
I. Possui o dobro da carga de um próton, ou seja, +2.
II. São elétrons emitidos dos núcleos dos átomos.
III. Tem grade poder de penetração, superior até 15 cm no aço.
IV. Tem velocidade igual à da luz.
Corresponde apenas às partículas betas a afirmativa
A afirmativa a seguir contextualiza a questão. Leia‐a atentamente.
“A corrosão é a deterioração de um material, geralmente metálico, por ação química ou eletroquímica do meio ambiente associada ou não a esforços mecânicos.”
(GENTIL, V. corrosão. LTC. 6ª ed. 2012.)
Nem sempre é possível, nem de interesse, ter as concentrações iônicas a 1M ou atividade unitária, por isso se utiliza certa equação para poder fazer o cálculo da determinação dos novos potenciais. Esta equação foi desenvolvida por qual cientista?“A meia-vida de um elemento radioativo é o intervalo de tempo em que uma amostra deste elemento se reduz à metade. Este intervalo de tempo também é chamado de período de semidesintegração. À medida que os elementos radioativos vão se desintegrando, no decorrer do tempo, a sua quantidade e atividade vão reduzindo e, por consequência, a quantidade de energia emitida por ele, em razão da radioatividade, também é reduzida.”
(ALMEIDA, Frederico Borges de. “Meia-Vida”; Brasil Escola. Disponível em http://brasilescola.uol.com.br/fisica/meiavida.htm. Acesso em: 24 de fevereiro de 2017.)
Assinale a alternativa que corresponde à massa residual de um material radioativo, que continha 10 g iniciais, após ter sua terceira meia-vida.