Questões Militares de Química - Transformações Químicas e Energia
Foram encontradas 372 questões
Águas termais, exploradas em diversos destinos turísticos, brotam naturalmente em fendas rochosas. O aquecimentonatural dessas águas, na sua grande maioria, deve-se ao calor liberado em processos radioativos de elementospresentes nos minerais rochosos que são transferidos para a água no fluxo pelas fendas. O gás radônio (222Rn) é oprovável responsável pelo aquecimento de diversas águas termais no Brasil. O 222Rn se origina do rádio (226Ra), nasérie do urânio (238U), naturalmente presente em granitos. O tempo de meia vida (t1/2) do 222Rn é de 3,8 dias, e esse seconverte em polônio (218Po), que por sua vez possui um t1/2 de 3,1 minutos. Considerando as informações dadas,considere as seguintes afirmativas:
1. A conversão de 222Rn em 218Po é um processo exotérmico.
2. A conversão de 226Ra em 222Rn emite quatro partículas β-.
3. Na série de decaimento, do 238U ao 218Po, cinco partículas α são emitidas.
4. Após 3,8 dias da extração da água termal, a concentração de 218Po atingirá a metade do valor da concentraçãoinicial de 222Rn.
Assinale a alternativa correta
1a Etapa: o composto A (C7H6O) sofre oxidação em solução básica de permanganato de potássio. O produto gerado, após neutralizado, é o ácido benzoico;
2a Etapa: o ácido benzoico reage com etanol em solução ácida, produzindo o composto B e água;
3a Etapa: o composto B sofre forte redução com hidreto de lítio-alumínio em éter, gerando dois produtos que, depois de neutralizados, formam então o composto C e o etanol.
Considerando as etapas supracitadas, são feitas as seguintes afirmações:
I) o composto A e o composto C são isômeros.
II) o composto B é um éster.
III) o composto B é o acetato de benzila.
Com base na análise das afirmações acima, assinale a opção correta.
As equações que representam as semirreações de cada espécie e os respectivos potenciais- padrão de redução (25 ºC e 1 atm) são apresentadas a seguir.
Zn2+(aq) + 2 e- → Zn (s) Eo = - 0,76 V
Ag+ (aq) + 1 e- → Ag (s) Eo = + 0,80 V
Com base nas informações apresentadas são feitas as afirmativas abaixo.
I – No eletrodo de zinco ocorre o processo químico de oxidação.
II – O cátodo da pilha será o eletrodo de prata.
III – Ocorre o desgaste da placa de zinco devido ao processo químico de redução do zinco.
IV – O sentido espontâneo do processo será Zn+2 + 2 Ago → Zno + 2 Ag+
V – Entre os eletrodos de zinco e prata existe uma diferença de potencial padrão de 1,56 V.
Estão corretas apenas as afirmativas
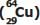 é de apenas 12,8 horas, pois ele sofre decaimento β se transformando em zinco, conforme a representação
é de apenas 12,8 horas, pois ele sofre decaimento β se transformando em zinco, conforme a representação  .
. Considerando uma amostra inicial de 128 mg de cobre-64, após 76,8 horas, a massa restante desse radioisótopo será de: