Questões Militares
Comentadas sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 250 questões
Observe a reação química abaixo.
Ca (OH)2 + CO2(g) → X + Y
A água de cal (hidróxido de cálcio) saturada é utilizada
para testar a presença de gás carbônico em uma mistura
gasosa. Ao borbulhar o gás carbônico, através da água de
cal, forma-se um precipitado branco (incógnita X) e outra
substância (incógnita Y ) . Quais as fórmulas químicas das
incógnitas X e Y representadas na reação acima, respectivamente?
Alcano → H2 + outros alcanos + X
Analise as afirmativas abaixo, com relação aos produtos da pirólise e assinale a alternativa correta.
I. Os outros alcanos são de cadeias maiores. II. Os outros alcanos são de cadeias menores. III. A substância X é um alceno.
C3H5(ONO2)3(ℓ)→N2(g)+CO2(g)+O2(g)+H2O(g)
Qual o volume aproximado de gás formado, ao nível do mar e a 27ºC, quando 2,27g da dinamite reagem?
I. As proporções molares com que os produtos são formados. II. Que a reação pode ocorrer. III. Que a reação é exotérmica. IV. A espontaneidade da reação. V. As fórmulas dos produtos.
Analise os processos abaixo e, em seguida, assinale a alternativa correta.
I. Diluir HCℓ em água.
II. 2 NO(g) + O2(g) 2 NO2(g)
III. NH4Cℓ(s) NH3(g) + HCℓ(g)
Uma análise dessas equações permite afirmar que:
Qual das opções apresenta a equação de uma reação que NÃO acontece pela ação estomacal desse medicamento?
Quanto à ordenação dos elementos na tabela e ao significado da característica que determina sua posição, é correto afirmar que a organização se dá em ordem:
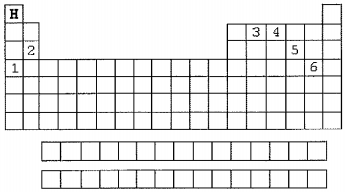
Analise as afirmativas abaixo referentes a esse esboço.
I - O elemento representado por 5 apresenta variantes alotrópicas quando forma moléculas de substâncias compostas.
II - A quantidade de elétrons que o elemento representado por 1 ganha é a mesma que aquele representado por 6 perde quando ambos sofrem ionização.
III- O elemento representado por 3 forma ligações covalentes quando se liga ao hidrogênio.
IV - O elemento indicado por 4 forma a substância simples mais abundante na atmosfera terrestre, e o elemento indicado por 2 faz parte da composição dos ossos humanos.
Assinale a opção correta.