Questões de Concurso Militar ITA 2020 para Vestibular - 1ª Fase
Foram encontradas 70 questões
Notações
ℕ = {1, 2, 3, . . . }: o conjunto dos números naturais.
ℝ : o conjunto dos números reais.
ℂ : o conjunto dos números complexos.
i : unidade imaginária, i2 = −1.
: segmento de reta de extremidades nos pontos A e B.
: ângulo formado pelos segmentos
e
, com vértice no ponto O.
m() : medida do segmento
.
Observação: Os sistemas de coordenadas considerados são os cartesianos retangulares.
I. (A + B)2 = A2 + 2AB + B2 . II. A comuta com qualquer matriz simétrica. III. B comuta com qualquer matriz antissimétrica. IV. det (A B) = 0.
É(são) VERDADEIRA(S):
Notações
ℕ = {1, 2, 3, . . . }: o conjunto dos números naturais.
ℝ : o conjunto dos números reais.
ℂ : o conjunto dos números complexos.
i : unidade imaginária, i2 = −1.
: segmento de reta de extremidades nos pontos A e B.
: ângulo formado pelos segmentos
e
, com vértice no ponto O.
m() : medida do segmento
.
Observação: Os sistemas de coordenadas considerados são os cartesianos retangulares.
Notações
ℕ = {1, 2, 3, . . . }: o conjunto dos números naturais.
ℝ : o conjunto dos números reais.
ℂ : o conjunto dos números complexos.
i : unidade imaginária, i2 = −1.
: segmento de reta de extremidades nos pontos A e B.
: ângulo formado pelos segmentos
e
, com vértice no ponto O.
m() : medida do segmento
.
Observação: Os sistemas de coordenadas considerados são os cartesianos retangulares.
Notações
ℕ = {1, 2, 3, . . . }: o conjunto dos números naturais.
ℝ : o conjunto dos números reais.
ℂ : o conjunto dos números complexos.
i : unidade imaginária, i2 = −1.
: segmento de reta de extremidades nos pontos A e B.
: ângulo formado pelos segmentos
e
, com vértice no ponto O.
m() : medida do segmento
.
Observação: Os sistemas de coordenadas considerados são os cartesianos retangulares.
Notações
ℕ = {1, 2, 3, . . . }: o conjunto dos números naturais.
ℝ : o conjunto dos números reais.
ℂ : o conjunto dos números complexos.
i : unidade imaginária, i2 = −1.
: segmento de reta de extremidades nos pontos A e B.
: ângulo formado pelos segmentos
e
, com vértice no ponto O.
m() : medida do segmento
.
Observação: Os sistemas de coordenadas considerados são os cartesianos retangulares.
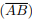 = 14, cos
= 14, cos 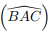 =
3/5
e cos
=
3/5
e cos 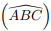 =
5/13 .
=
5/13 .
Então, o raio da circunferência inscrita ao triângulo é igual a:
Notações
ℕ = {1, 2, 3, . . . }: o conjunto dos números naturais.
ℝ : o conjunto dos números reais.
ℂ : o conjunto dos números complexos.
i : unidade imaginária, i2 = −1.
: segmento de reta de extremidades nos pontos A e B.
: ângulo formado pelos segmentos
e
, com vértice no ponto O.
m() : medida do segmento
.
Observação: Os sistemas de coordenadas considerados são os cartesianos retangulares.
Notações
ℕ = {1, 2, 3, . . . }: o conjunto dos números naturais.
ℝ : o conjunto dos números reais.
ℂ : o conjunto dos números complexos.
i : unidade imaginária, i2 = −1.
: segmento de reta de extremidades nos pontos A e B.
: ângulo formado pelos segmentos
e
, com vértice no ponto O.
m() : medida do segmento
.
Observação: Os sistemas de coordenadas considerados são os cartesianos retangulares.
A única solução real da equação
7x = 59x-1
pertence ao intervalo:
Notações
ℕ = {1, 2, 3, . . . }: o conjunto dos números naturais.
ℝ : o conjunto dos números reais.
ℂ : o conjunto dos números complexos.
i : unidade imaginária, i2 = −1.
: segmento de reta de extremidades nos pontos A e B.
: ângulo formado pelos segmentos
e
, com vértice no ponto O.
m() : medida do segmento
.
Observação: Os sistemas de coordenadas considerados são os cartesianos retangulares.
Seja A uma matriz real quadrada de ordem 2 tal que
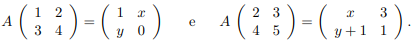
Então, o traço da matriz A é igual a:
Notações
ℕ = {1, 2, 3, . . . }: o conjunto dos números naturais.
ℝ : o conjunto dos números reais.
ℂ : o conjunto dos números complexos.
i : unidade imaginária, i2 = −1.
: segmento de reta de extremidades nos pontos A e B.
: ângulo formado pelos segmentos
e
, com vértice no ponto O.
m() : medida do segmento
.
Observação: Os sistemas de coordenadas considerados são os cartesianos retangulares.
Notações
ℕ = {1, 2, 3, . . . }: o conjunto dos números naturais.
ℝ : o conjunto dos números reais.
ℂ : o conjunto dos números complexos.
i : unidade imaginária, i2 = −1.
: segmento de reta de extremidades nos pontos A e B.
: ângulo formado pelos segmentos
e
, com vértice no ponto O.
m() : medida do segmento
.
Observação: Os sistemas de coordenadas considerados são os cartesianos retangulares.
Seja ABCD um quadrilátero convexo com diagonais 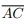 e
e 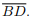 Considere as afirmações:
Considere as afirmações:
I. Se as diagonais 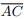 e
e 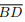 têm mesmo comprimento e se intersectam ortogonalmente, então ABCD é
um losango.
têm mesmo comprimento e se intersectam ortogonalmente, então ABCD é
um losango.
II. Se as diagonais 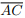 e
e 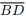 dividem o quadrilátero ABCD em quatro triângulos de mesma área, então
ABCD é um paralelogramo.
dividem o quadrilátero ABCD em quatro triângulos de mesma área, então
ABCD é um paralelogramo.
III. Se o ponto de interseção das diagonais 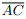 e
e 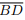 é o centro do círculo que circunscreve o quadrilátero
ABCD, então ABCD é um retângulo.
é o centro do círculo que circunscreve o quadrilátero
ABCD, então ABCD é um retângulo.
É(são) VERDADEIRA(S):
Notações
ℕ = {1, 2, 3, . . . }: o conjunto dos números naturais.
ℝ : o conjunto dos números reais.
ℂ : o conjunto dos números complexos.
i : unidade imaginária, i2 = −1.
: segmento de reta de extremidades nos pontos A e B.
: ângulo formado pelos segmentos
e
, com vértice no ponto O.
m() : medida do segmento
.
Observação: Os sistemas de coordenadas considerados são os cartesianos retangulares.
Considere as seguintes afirmações:
I. Se a medida do ângulo agudo entre uma reta r e um plano α é 45°, então existe uma reta s contida em α tal que a medida do ângulo agudo entre r e s é 30° .
II. Se uma reta r é perpendicular a duas retas distintas s e t contidas em um plano α, então r é perpendicular a α.
III. Sejam r, s e t as três retas distintas determinadas por três pontos não colineares. Então, existe um único ponto equidistante de r, s e t.
IV. Se P e Q são pontos à mesma distância de um plano α, então o ponto médio do segmento 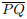 pertence
a α.
pertence
a α.
É(são) VERDADEIRA(S):
Notações
ℕ = {1, 2, 3, . . . }: o conjunto dos números naturais.
ℝ : o conjunto dos números reais.
ℂ : o conjunto dos números complexos.
i : unidade imaginária, i2 = −1.
: segmento de reta de extremidades nos pontos A e B.
: ângulo formado pelos segmentos
e
, com vértice no ponto O.
m() : medida do segmento
.
Observação: Os sistemas de coordenadas considerados são os cartesianos retangulares.
Notações
ℕ = {1, 2, 3, . . . }: o conjunto dos números naturais.
ℝ : o conjunto dos números reais.
ℂ : o conjunto dos números complexos.
i : unidade imaginária, i2 = −1.
: segmento de reta de extremidades nos pontos A e B.
: ângulo formado pelos segmentos
e
, com vértice no ponto O.
m() : medida do segmento
.
Observação: Os sistemas de coordenadas considerados são os cartesianos retangulares.
Notações
ℕ = {1, 2, 3, . . . }: o conjunto dos números naturais.
ℝ : o conjunto dos números reais.
ℂ : o conjunto dos números complexos.
i : unidade imaginária, i2 = −1.
: segmento de reta de extremidades nos pontos A e B.
: ângulo formado pelos segmentos
e
, com vértice no ponto O.
m() : medida do segmento
.
Observação: Os sistemas de coordenadas considerados são os cartesianos retangulares.
Notações
ℕ = {1, 2, 3, . . . }: o conjunto dos números naturais.
ℝ : o conjunto dos números reais.
ℂ : o conjunto dos números complexos.
i : unidade imaginária, i2 = −1.
: segmento de reta de extremidades nos pontos A e B.
: ângulo formado pelos segmentos
e
, com vértice no ponto O.
m() : medida do segmento
.
Observação: Os sistemas de coordenadas considerados são os cartesianos retangulares.
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio


Sabe-se que a bateria converte Pb e PbO2 em PbSO4 na descarga e que, em condições normais, o pH da solução eletrolítica é menor que 1.
A respeito dessa bateria, foram feitas as seguintes afirmações:
I. Em condições normais, durante a descarga, a semirreação principal que ocorre no ânodo é a i e, no cátodo, é a iv. II. Em condições normais, o potencial da bateria no equilíbrio pode ser representado por E = 1,93 − 0,06pH + 0,06log
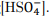 III. Em condições padrão, a eletrólise da água sempre acontece.
IV. Em pH ∼ 2, os potenciais das semirreações secundárias igualam-se aos potenciais das semirreações
principais do ânodo e do cátodo, respectivamente, portanto a eletrólise da água não ocorre
quando o eletrólito tem pH > 2.
III. Em condições padrão, a eletrólise da água sempre acontece.
IV. Em pH ∼ 2, os potenciais das semirreações secundárias igualam-se aos potenciais das semirreações
principais do ânodo e do cátodo, respectivamente, portanto a eletrólise da água não ocorre
quando o eletrólito tem pH > 2. Considerando apenas argumentos baseados no equilíbrio termodinâmico a 25 °C, está(ão) ERRADA(S) apenas a(s) afirmação(ões)
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

I. Penteno e ciclopentano não são isômeros estruturais, enquanto butano e ciclobutano são. II. Cloroeteno pode sofrer polimerização por adição, enquanto o tetrafluoretano não. III. 2-Bromopropano é opticamente ativo, enquanto 1,2-dicloropentano não é. IV. Sob exposição à luz, a reação entre cloro e metano ocorre por substituição. Por outro lado, na ausência de luz, a reação entre bromo e eteno ocorre por adição. V. A desidratação intramolecular de álcoois orgânicos forma alcenos.
Das afirmações acima, está(ão) CORRETA(S) apenas
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

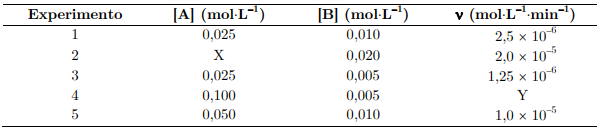
Com base nesses experimentos, assinale a opção que apresenta os valores corretos de α, β, k, X e Y, respectivamente.
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

I. O comprimento de ligação e a energia de ligação são influenciados pela multiplicidade da ligação, pela ressonância e pelo raio atômico. II. Cargas formais consideram ligações químicas perfeitamente covalentes ao assumir que os elétrons são igualmente compartilhados. III. O poder de polarização de um cátion é maior quanto maiores forem o seu volume e a sua carga. A interação deste cátion com um ânion altamente polarizável tende a apresentar um maior caráter covalente. IV. Na ressonância há uma diminuição da energia em função da contribuição de estruturas que possuem a mesma geometria, porém com diferentes arranjos dos elétrons.
Das afirmações acima, está(ão) ERRADA(S) apenas