Questões de Concurso Militar CBM-PR 2014 para Aspirante do Corpo de Bombeiro
Foram encontradas 9 questões
“Gelo de fogo” escondido em permafrost é fonte de energia do futuro? Conhecido como "gelo que arde", o hidrato de metano consiste em cristais de gelo com gás preso em seu interior. Eles são formados a partir de uma combinação de temperaturas baixas e pressão elevada e são encontrados no limite das plataformas continentais, onde o leito marinho entra em súbito declive até chegar ao fundo do oceano. Acredita-se que as reservas dessa substância sejam gigantescas. A estimativa é de que haja mais energia armazenada em hidrato de metano do que na soma de todo petróleo, gás e carvão do mundo. Ao reduzir a pressão ou elevar a temperatura, a substância simplesmente se quebra em água e metano – muito metano. Um metro cúbico do composto libera cerca de 160 metros cúbicos de gás a pressão e temperatura ambiente, o que o torna uma fonte de energia altamente intensiva.
Disponível em: http://www.bbc.co.uk/portuguese/noticias/2014/04/140421_energia_metano_ms.shtml.
Acessado em 21/04/2014. Texto adaptado.
Dado: R = 8,2 x 10-5 m3 atm K-1 mol-1
Para armazenar todo o gás do interior de 1 m3 de “gelo de fogo” num cilindro de 1 m3 e a temperatura de 0°C, é necessária uma pressão (em atm) de
Águas termais, exploradas em diversos destinos turísticos, brotam naturalmente em fendas rochosas. O aquecimentonatural dessas águas, na sua grande maioria, deve-se ao calor liberado em processos radioativos de elementospresentes nos minerais rochosos que são transferidos para a água no fluxo pelas fendas. O gás radônio (222Rn) é oprovável responsável pelo aquecimento de diversas águas termais no Brasil. O 222Rn se origina do rádio (226Ra), nasérie do urânio (238U), naturalmente presente em granitos. O tempo de meia vida (t1/2) do 222Rn é de 3,8 dias, e esse seconverte em polônio (218Po), que por sua vez possui um t1/2 de 3,1 minutos. Considerando as informações dadas,considere as seguintes afirmativas:
1. A conversão de 222Rn em 218Po é um processo exotérmico.
2. A conversão de 226Ra em 222Rn emite quatro partículas β-.
3. Na série de decaimento, do 238U ao 218Po, cinco partículas α são emitidas.
4. Após 3,8 dias da extração da água termal, a concentração de 218Po atingirá a metade do valor da concentraçãoinicial de 222Rn.
Assinale a alternativa correta
A biodegradação da matéria orgânica produz substâncias húmicas, nas quais os principais componentes são os ácidos húmicos. Estes correspondem a diversas estruturas complexas, que possuem na maioria substituintes fenólicos (pKa = 8) e carboxílicos (pKa = 4). Além de alterar o pH do meio, também são capazes de se ligar a íons metálicos formando coloides. Sobre esse tema, considere as seguintes afirmativas:
1. A presença de substâncias húmicas torna o pH menor que 7. 2. A presença de substâncias húmicas ligadas a íons metálicos é detectada pelo turvamento do meio.
3. O valor medido de pH 6 em uma amostra indica que praticamente todos os substituintes fenólicos estão protonados, enquanto que os substituintes carboxílicos estão desprotonados.
4. O valor medido de pH 4 em uma amostra indica que 50% dos substituintes carboxílicos estão protonados.
Assinale a alternativa correta.
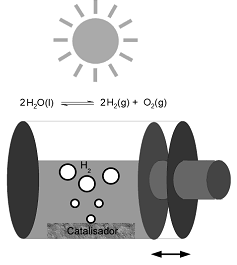
Recentemente, a produção fotocatalítica de hidrogênio vem atraindo atenção devido ao processo que gera um combustível limpo, o qual é utilizado em células a combustível. O processo se baseia na separação da água nos seus componentes, conforme equilíbrio inserido no esquema, utilizando luz solar e um fotocatalisador (p. ex. NaTaO3:La). O processo é extremamente endotérmico, necessitando 1,23 eV para ocorrer. Num experimento, o processo foi realizado num sistema fechado, como esquematizado abaixo. Considerando essas informações, identifique as afirmativas a seguir como verdadeiras (V) ou falsas (F):
( ) A quantidade de fotocatalisador limita a conversão.
( ) O aumento da temperatura irá favorecer a conversão.
( ) A diminuição do volume do sistema irá favorecer a conversão.
( ) É condição necessária para a produção de hidrogênio que o fotocatalisador absorva energia solar superior a 1,23 eV.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
O palito de fósforo é um dos artigos mais úteis no nosso cotidiano. Na sua composição, possui fósforo vermelho, enxofre e clorato de potássio. A cabeça de um palito de fósforo pesa aproximadamente 0,05 g. A reação que ocorre na queima da cabeça de fósforo está representada a seguir:
3 P4 + S + 10 KClO3 + O2 → 3 P4O10 + 10 KCl + SO2
O cheiro característico de “fósforo queimado” se deve ao dióxido de enxofre formado.
Dados: No palito de fósforo, os componentes estão em quantidades estequiométricas. M (g mol-1): Cl = 35,5; K = 39; O= 16;P = 31; S = 32.
A massa (em g) de dióxido de enxofre produzido ao queimar uma cabeça de fósforo é aproximadamente:
O salicilato de metila é um produto natural amplamente utilizado como analgésico tópico para alívio de dores musculares, contusões etc. Esse composto também pode ser obtido por via sintética a partir da reação entre o ácido salicílico e metanol, conforme o esquema abaixo:
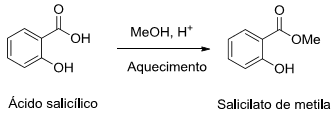
A reação esquematizada é classificada como uma reação de:
A reação de hidrólise da acetilcolina, esquematizada abaixo, é fundamental na transmissão de impulsos nervosos nos seres vivos. A reação é promovida pela enzima acetilcolinesterase (AChE).
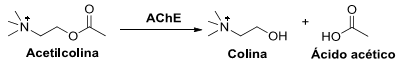
Considere as seguintes afirmativas sobre o papel de AChE nessa reação:
1. AChE é catalisador da reação.
2. AChE aumenta a energia de ativação da reação.
3. AChE promove caminhos reacionais alternativos.
4. AChE inibe a formação de intermediários.
Assinale a alternativa correta.
A retina do olho humano contém dois tipos de células especializadas: os cones e os bastonetes. Nos bastonetes acontece uma transformação química fundamental para a química da visão. Trata-se da conversão do retinol (Vitamina A) em retinal que, na sequência, sofrerá outras transformações.
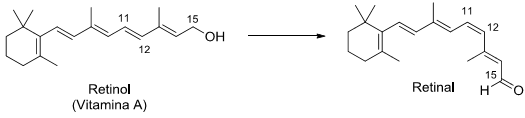
Sobre o tema, considere as seguintes afirmativas:
1. O grupo funcional álcool no retinol é convertido a aldeído no retinal.
2. A ligação dupla entre os carbonos 11 e 12 sofre uma reação de isomerização.
3. A molécula do retinal apresenta um grau de oxidação superior ao do retinol.
4. A molécula do retinol apresenta um centro quiral no carbono 15.
Assinale a alternativa correta.
A análise dos dados termodinâmicos de reações permite a previsão da espontaneidade. Na tabela a seguir estão apresentados os dados termodinâmicos de duas reações químicas.
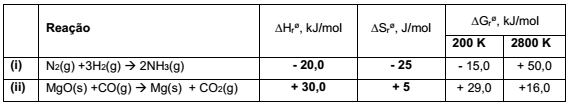
A partir dos dados apresentados, identifique as seguintes afirmativas como verdadeiras (V) ou falsas (F):
( ) A diminuição da temperatura desfavorece a espontaneidade da reação (i).
( ) O aumento da temperatura favorece a espontaneidade da reação (ii).
( ) Na temperatura de 400 K, a reação (i) será espontânea.
( ) Na temperatura de 4000 K, a reação (ii) será espontânea.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.