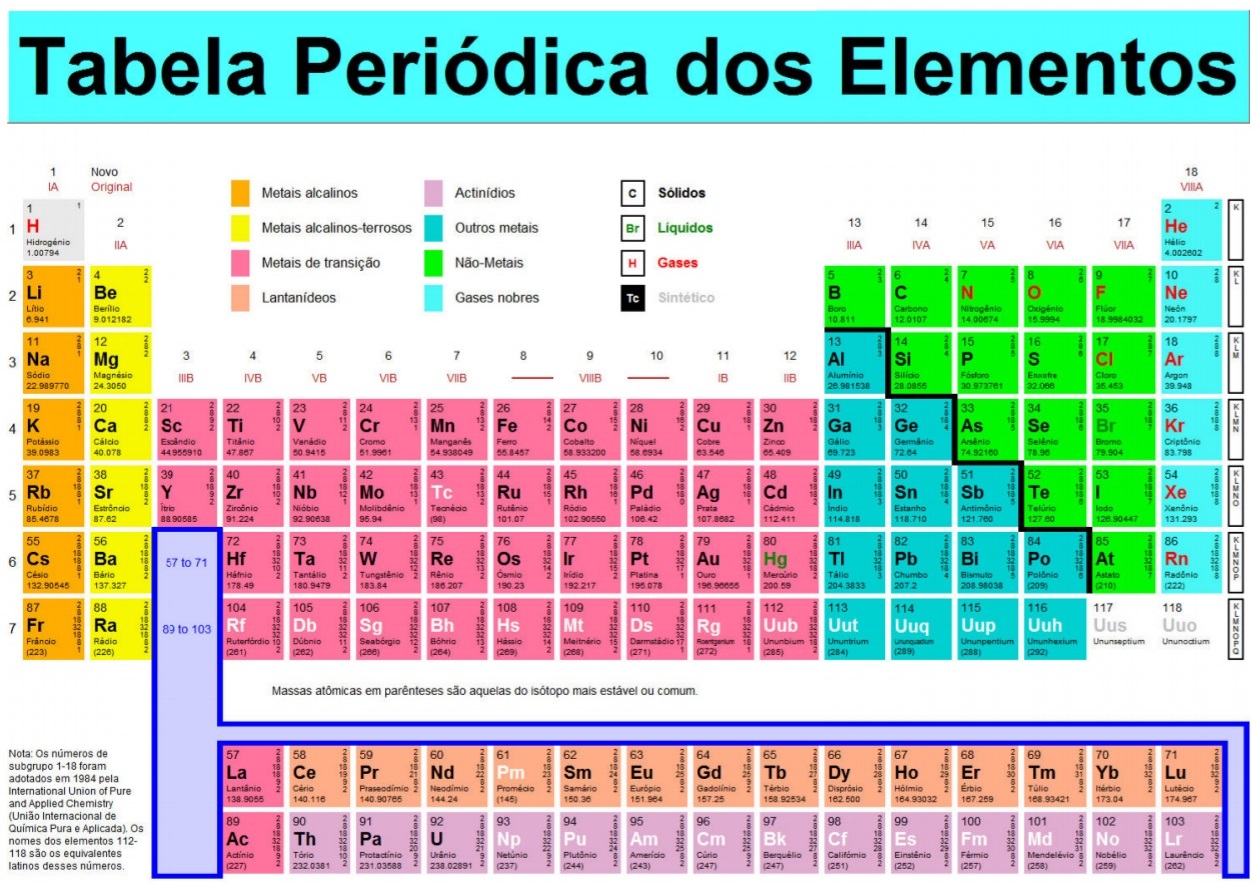
Desde os primórdios, os químicos são responsáveis pela evol...
- Gabarito Comentado (1)
- Aulas (10)
- Comentários (2)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Gabarito do Professor: Letra A.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
Anulação da questão.
A Afinidade Eletrônica na realidade cresce no grupo de baixo pra cima, tendo valores menores ao longo do grupo, ao contrário do que a alternativa afirmou
Complementando...
GABARITO DA BANCA: A
GABARITO DOS PROFESSORES de QUÍMICA: D (A afinidade eletrônica cresce no grupo de baixo para cima.).
Deveria ser anulada mesmo.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo