A fórmula estrutural da água e da água oxigenada são apresen...
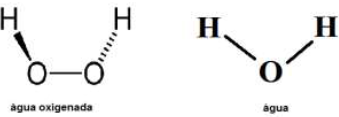
Em relação ao ponto de ebulição dessas duas substâncias, é correto afirmar que o maior ponto de ebulição é o da
Comentários
Veja os comentários dos nossos alunos
Bizu
Composto molecular (não dissocia) obs: ametal/ametal e hidrogênio é ligação covalente.
Ex: C6H12O6 (se eu tenho 2 mol/L eu tenho 2 mols de partículas)
Composto Iônico (dissocia) obs: metal/ametal é ligação iônica.
Ex: CaCl2= Ca + 2CL- = (1 mol + 2 mols) = 3 mols de partículas
OBS: Quanto maior a quantidade de partículas: menor é a pressão de vapor, maior a temperatura de ebulição, menor temperatura de congelamento e maior pressão osmótica.
Reação de decomposição da água oxigenada:
H2O2 - 2H2O + O2
Logo, forma-se 2 moléculas de água e cada molécula têm duas ligações de hidrogênio. Sendo assim, a molécula de água oxigenada possui 4 ligações de hidrogênio e, por esse motivo, a presenta maior ponto de ebulição quando comparada com a molécula de água que faz apenas 2 ligações de hidrogênio.
cada molécula de água consegue se ligar a outras quatro moléculas de água por meio de pontes de hidrogênio. Já a água oxigenada consegue realizar 6. Quanto maior as forças intermoleculares maior será o ponto de ebulição.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo