De acordo com o conceito de ácido-base de BronstedLowry, an...
De acordo com o conceito de ácido-base de BronstedLowry, analise as equações abaixo.
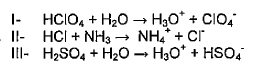
Com base nas equações acima, é INCORRETO afirmar
que
Comentários
Veja os comentários dos nossos alunos
Posso estar errado, mas fui logo na letra c porque nunca vi ácido clorídrico atuando como base.
GABARITO: LETRA C
LEMBRANDO ELE QUER A INCORRETA...
a) I ClO4(-) é base conjugada do HClO4.
Correta, observamos que o HClO4 é um ácido e o ClO4(-) é uma base, logo a afirmação está correta pois todo ácido na teoria de BronstedLowry precisa de uma base conjugada, assim como uma base precisa de um ácido conjudado
b) II NH4 é ácido conjugado da NH3.
Correta, verificamos que o NH3 é uma base logo ele precisa ter seu ácido conjugado que no caso é o NH4 e sua base conjugada é o Cl(-)
c) II, HCl atua como base.
Errada, se verificarmos temos que o HCl atua como um ácido pois ele cede próton(H+) formando o NH4(+)
d) III, H2SO4 atua como ácido.
Correta, ela atua como um ácido sim pois ela cede próton formando assim o H3O(+)
e) III, HSO4- atua como base.
Correta, observe que nos reagentes ela atuava como ácido, como ela cedeu seu próton ela passa a ser nos produtos uma base
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo