Observe o diagrama pressão versus volume a seguir. ...
Observe o diagrama pressão versus volume a seguir.
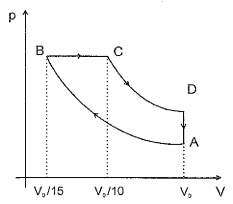
Esse diagrama representa uma máquina térmica operando o chamado Ciclo de Diesel, era que 10 moles de uma mistura de ar e gasolina (tratada como um gás ideal) sofrem uma compressão adiabática (AB), depois um aquecimento à pressão constante (BC), seguido por uma expansão adiabática (CD), que move o pistão, e, finalmente, um resfriamento isométrico (DA), retornando ao estado inicial. Como o ar é essencialmente uma mistura de gases diatômicos, considere a capacidade térmica à pressão constante do gás em questão como Cp= (7/2) R.
Considerando ainda o ponto A nas CNTP e sabendo que a pressão no trecho BC é 55atm, calcule o calor absorvido neste trecho e assinale a opção correta.
Dado: R=8,31 J/molKComentários
Veja os comentários dos nossos alunos
Não consegui chegar na resposta. Alguém conseguiu?
Esse exercício eu quebrei a cabeça pra entender, mas consegui ;D
Vamos lá: a questão pede o calor absorvido no trecho BC, e sabemos que nesse trecho a pressão é isobárica. Só que o pulo do gato, é saber que o volume molar em CNTP É 22,4 L, que a questão não fornece.
Primeiro devemos achar a temperatura em A:
Ta= P*V/ N*R= (55)*(22,4)/ 10*8,31*15= 1,000* 10^2
Tb= P*V/ N*R= 55* 22,4/ 10* 8,31*10= 1,500*10^2
Depois de acharmos a temperatura, temos que achar o calor absorvido que será
Qa= N* CP* AT
= 10* (7/2)* 8,31* Tb-Ta= 1,45*10^5 j
LETRA B
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo