Questões Militares
Para aeronáutica
Foram encontradas 32.314 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A Difração de Raios X de Pós se tornou uma técnica extremamente importante para fármacos, pois representa o método primário para a obtenção de informações fundamentais sobre a estrutura de uma substância cristalina. Nesta técnica, os resultados obtidos são representados graficamente na forma de difratogramas de raios X.
Informe se é verdadeiro (V) ou falso (F) o que se afirma sobre a análise de difração de raios X.
( ) Uma fase cristalina de uma substância pode produzir um ou mais padrões de difração de raios X.
( ) Uma das principais características dos picos ou perfis de linha de difração em um difratograma de raios X é a sua posição em 2θ, que indica a posição angular do feixe de raio X difratado pelo cristalito.
( ) A difração dos raios X por uma substância cristalina ocorre de acordo com a Equação ou Lei de Bragg.
A sequência correta é
Como informar as crianças em momentos de crise?
Maria Carolina Cristianini*
1§ Enfrentar crises não é novidade para quem vive na Terra. Entre guerras, períodos de recessão e tragédias naturais e humanas, de tempos em tempos as crises surgem. É necessário muita sobriedade nesses momentos. E, então, são os adultos que, efetivamente, assumem o papel de lidar com a situação e resolvê-la – conforme a possibilidade de atuação de cada um. Mas há outra questão. O mundo não é formado somente pelos maiores de idade.
2§ É a partir disso que convido a uma reflexão: como os adultos ao seu redor, ou você mesmo, têm explicado a crise atual – e os seus mais diversos sentidos –, causada pela pandemia de Covid 19, a crianças e adolescentes? Posso afirmar, com a segurança de uma trajetória que passa de 12 anos nesta área, que o jornalismo infantojuvenil é, sim, o melhor amigo de pais, mães, tios, tias, professores e professoras neste momento.
3§ Levar os fatos para os jovens, apurados com as mesmas técnicas usadas no jornalismo profissional “para adultos”, tem, sim, os mais diversos benefícios quando se está diante de algo que presenciamos pela primeira vez, como o novo coronavírus. Alguns desses impactos positivos: usa linguagem adequada para este público, garantindo o seu entendimento e o contexto do que está acontecendo; acalma diante da ansiedade que algo desconhecido naturalmente traz; e abre a oportunidade para que a criança ou o adolescente se sinta inserido na situação como parte integrante e ativa da sociedade, sem estar à margem do noticiário.
4§ O jornalismo infantojuvenil pode transformar uma geração, a partir da informação de qualidade e do incentivo ao desenvolvimento do senso crítico e à construção de uma cidadania ativa, em qualquer idade.
* Editora-chefe do jornal Joca, voltado para crianças e jovens. Folha de S. Paulo, Tendências/Debates, 21 fev. 2021, p. A3. Adaptado.
“Na língua portuguesa, para construir sentido nos enunciados que produzimos, os verbos e nomes ligam-se a outros termos de diferentes formas. [...] Quando um termo – verbo ou nome – exige a presença de outro, ele se chama regente ou subordinante; os que completam a sua significação chamam-se regidos ou subordinados. Quando o termo regente é um verbo, ocorre regência verbal. Quando o termo regente é um nome – substantivo, adjetivo, advérbio –, ocorre regência nominal”.
CEREJA, William Roberto; MAGALHÃES, Thereza Cochar. Gramática reflexiva –
texto, semântica e interação. São Paulo: Atual, 2013, p. 355-356.
Com base nesse postulado, é correto afirmar que, no período “O jornalismo infantojuvenil pode transformar uma geração, a partir da informação de qualidade e do incentivo ao desenvolvimento do senso crítico e à construção de uma cidadania ativa, em qualquer idade.” (4§), os termos “uma geração” e “de uma cidadania ativa” devem ser analisados, respectivamente, como
Adolescer: o luto pelo fim da infância e o medo da vida adulta
Bebel Soares*

1§ Aprendi a reconhecer meus sentimentos. A entender cada um deles. A controlar a fúria, a raiva. Aprendi a acolher a tristeza, a frustração. Aprendi a deixar transbordar a alegria, a euforia. Depois de muito tempo, amadureci.
2§ Hoje sou brisa, mas já fui vendaval. Hoje sou montanha, mas já fui vulcão. Adolescer é uma tempestade. O luto pelo fim da infância, o medo da vida adulta. Os conflitos internos. As emoções transbordando, às vezes incontroláveis.
3§ Ser adolescente é um desafio para quem é e para os responsáveis por esse ser em transformação. Hoje sou adulta e me preparo para ser mãe de adolescente.
4§ Adolescentes precisam é confiar no amor incondicional dos pais. Saber que estaremos por perto, mesmo ouvindo desaforos. Saber que estamos fazendo o certo, mesmo quando eles acham que está tudo errado. Que não vamos desistir deles. Que vamos insistir para que estudem. Que vamos repetir a mesma coisa mil vezes para ter certeza de que eles ouviram.
5§ Adolescente não é adulto, e não é mais criança, e a gente se lembra tanto do que eles não são, que se esquece do que eles são. Esse é um desafio, olhar para o que eles são hoje, agora, e não o que eles deixaram de ser, ou o que eles não são ainda. Deixar de ver o que falta e olhar para as potências, as capacidades.
6§ Difícil é aceitar que eles estão crescendo e que está chegando a hora de deixarmos que voem sozinhos.
* Fundadora da Rede Materna Padecendo no Paraíso.
Estado de Minas, Bem Viver, 21 fev. 2021, p. 6. Adaptado.
O youtuber e Machado de Assis, ou uma polêmica bem-vinda
Cláudia Costin*
1§ Uma polêmica apareceu nos últimos dias, nas redes sociais, a partir de um comentário do youtuber Felipe Neto, sobre a atitude de escolas que tornam as obras de Machado de Assis obrigatórias. Segundo ele, o que estas deveriam promover seria a leitura por prazer, de forma a constituir, nas jovens mentes, o hábito de ler como uma atividade para toda a vida.
2§ Devo me confessar uma grande admiradora de Machado de Assis, um de nossos maiores escritores, um homem à frente de sua época, crítico de valores associados a aparências e à superficialidade humana na busca de status e do bacharelismo vigente. Mas entendi que nem sempre a linguagem do século 19 pode ser fácil para os adolescentes deste tempo de informações imediatas e superficiais.
3§ Num contexto em que adultos letrados leem muito pouco e não são vistos lendo livros por seus filhos, é compreensível que os jovens não percam tempo lendo outra coisa que não o que a escola lhes exige. A última edição da pesquisa Retratos da Leitura coloca-nos claramente como um país de não leitores. A média de livros lidos entre os entrevistados por ano é de 4,95 e só 2,55 deles lidos por inteiro.
4§ Cabe sim à escola fomentar a leitura por prazer, oferecendo livros que atraiam o interesse das novas gerações. Em tempos em que o trabalho humano, inclusive o que demanda habilidades mentais, vem sendo substituído por algoritmos, formar pensadores independentes, com um repertório cultural variado, aptos a entender a cultura de seu tempo e sua gênese, torna-se uma prioridade.
5§ E a literatura nos ajuda a entender não só fatos pretéritos, mas as análises que, a cada época, eram feitas sobre a organização da sociedade. Machado, nesse sentido, é fundamental e merece, dia a dia, uma introdução à altura, instigante e engajadora, feita por bons professores, que orientem os alunos na leitura de suas obras e os ajudem a nelas navegar com profundidade e prazer estético.
* Diretora do Centro de Excelência e Inovação em Políticas Educacionais, da FGV, e ex-diretora de educação do Banco Mundial. Folha de S. Paulo, Opinião, 29 jan. 2021, p. A2. Adaptado.
Leia os textos a seguir.
TEXTO I
“A preposição a e o artigo a se fundem em um único a, dando origem ao fenômeno chamado crase.”
CEREJA, William Roberto; MAGALHÃES, Thereza Cochar. Gramática reflexiva
– texto, semântica e interação. São Paulo: Atual, 2013, p. 361.
TEXTO II

Disponível em: https://www.cors.com.br/noticias-e-dicas-medicas/coronavirus-
previna-se-e-ajude-a-salvar-vidas/. Acesso em 26 fev. 2021.
Com base no conceito apresentado no Texto I, a ausência do sinal indicativo de crase no Texto II ocorre pelo
mesmo motivo que em
O youtuber e Machado de Assis, ou uma polêmica bem-vinda
Cláudia Costin*
1§ Uma polêmica apareceu nos últimos dias, nas redes sociais, a partir de um comentário do youtuber Felipe Neto, sobre a atitude de escolas que tornam as obras de Machado de Assis obrigatórias. Segundo ele, o que estas deveriam promover seria a leitura por prazer, de forma a constituir, nas jovens mentes, o hábito de ler como uma atividade para toda a vida.
2§ Devo me confessar uma grande admiradora de Machado de Assis, um de nossos maiores escritores, um homem à frente de sua época, crítico de valores associados a aparências e à superficialidade humana na busca de status e do bacharelismo vigente. Mas entendi que nem sempre a linguagem do século 19 pode ser fácil para os adolescentes deste tempo de informações imediatas e superficiais.
3§ Num contexto em que adultos letrados leem muito pouco e não são vistos lendo livros por seus filhos, é compreensível que os jovens não percam tempo lendo outra coisa que não o que a escola lhes exige. A última edição da pesquisa Retratos da Leitura coloca-nos claramente como um país de não leitores. A média de livros lidos entre os entrevistados por ano é de 4,95 e só 2,55 deles lidos por inteiro.
4§ Cabe sim à escola fomentar a leitura por prazer, oferecendo livros que atraiam o interesse das novas gerações. Em tempos em que o trabalho humano, inclusive o que demanda habilidades mentais, vem sendo substituído por algoritmos, formar pensadores independentes, com um repertório cultural variado, aptos a entender a cultura de seu tempo e sua gênese, torna-se uma prioridade.
5§ E a literatura nos ajuda a entender não só fatos pretéritos, mas as análises que, a cada época, eram feitas sobre a organização da sociedade. Machado, nesse sentido, é fundamental e merece, dia a dia, uma introdução à altura, instigante e engajadora, feita por bons professores, que orientem os alunos na leitura de suas obras e os ajudem a nelas navegar com profundidade e prazer estético.
* Diretora do Centro de Excelência e Inovação em Políticas Educacionais, da FGV, e ex-diretora de educação do Banco Mundial. Folha de S. Paulo, Opinião, 29 jan. 2021, p. A2. Adaptado.
Observe o cartaz a seguir.

Disponível em:<https://www.youtube.com/watch?v=YSB24kjvF_g> .
Acesso em: 26 fev. 2021.
A respeito do processo de elaboração do texto verbal e não verbal do cartaz, e considerando, ainda, sua relação com o artigo “O youtuber e Machado de Assis, ou uma polêmica bem-vinda”, avalie o que se afirma a seguir.
I. O verbo “cancelar” foi empregado com uma nova acepção.
II. O texto está em dissintonia com uma das discussões propostas no artigo.
III. O fato que deu origem ao cartaz refere-se a um acontecimento midiático.
IV. O diálogo com o texto de Cláudia Costin se realiza, mas sem fornecer pistas.
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

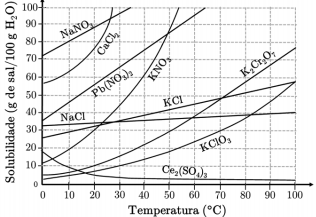
I. Dissolvendo-se 130 g de KNO3 em 200 g de água, a 40 °C, obteremos uma solução saturada com depósito de 70 g desta substância que não será dissolvida. II. Se dissolvermos 20 g de Ce2(SO4)3 em 300 g de água a 10 °C e, posteriormente, aquecermos esta solução a 90 °C, haverá gradativa precipitação da substância. III. A menor quantidade de água necessária para dissolver completamente 140 g de K2Cr2O7 a 90 °C é, aproximadamente, 150 g. IV. NaNO3 é a substância mais solúvel a 30 °C.
Das afirmações acima, está(ão) CORRETA(S)
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

(1) O volume da solução de permanganato de potássio gasto na titulação foi de 100 mL. (2) O menor coeficiente estequiométrico inteiro para Fe2+ na reação redox balanceada é 7. (3) No ponto final, o volume total da solução será de 120 mL. (4) Um precipitado sólido de cor esverdeada será observado como produto dessa reação. (5) O número total de elétrons envolvidos na reação redox é 22 milimols. (6) A razão entre os volumes do titulante e do titulado no ponto final é 2,1.
A soma dos números associados às afirmações CORRETAS é igual a
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

(1) A intensidade da luz depende da frequência ou do comprimento de onda da radiação empregada. (2) Dentre as cores do espectro visível, a azul é a que possui maior intensidade devido ao seu menor comprimento de onda. (3) Dentro do espectro visível, a luz vermelha é a radiação que possui o menor comprimento de onda. (4) O estado do elétron em um átomo é completamente definido pelos números quânticos n, l, ml . (5) A configuração eletrônica dos átomos é determinada pelo princípio da construção, pelo princípio da exclusão de Pauli e pela regra de Hund. (6) Na tabela periódica, os pares de elementos com relação diagonal geralmente exibem propriedades químicas semelhantes.
A soma dos números associados às sentenças ERRADAS é igual a
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

(1) O ponto de fusão do argônio é menor que o do xenônio em uma mesma pressão. (2) A pressão de vapor do dimetilpropano é maior que a do pentano. (3) O valor absoluto da energia potencial de interação entre a molécula de água e o Ca2+ é menor do que entre a molécula de água e o Al3+ . (4) O valor absoluto da energia potencial de interação entre a molécula de água e o Ga3+ é maior do que entre a molécula de água e o Al3+ .
A soma dos números associados às proposições ERRADAS é igual a
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

I. A entropia permanece constante em um sistema fechado que sofre a ação de um processo reversível. II. A variação de entropia é nula dentro do sistema quando ele opera em um ciclo de Carnot. III. O valor absoluto da variação da energia interna de um gás ideal numa expansão reversível adiabática é maior que numa expansão reversível isotérmica. IV. Energia interna é uma propriedade cuja variação pode ser medida pelo trabalho adiabático realizado entre dois estados.
Das afirmações acima, está(ão) ERRADA(S) apenas
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

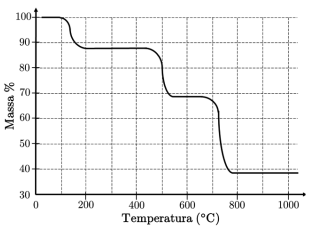
Com base nessa figura e sabendo que a massa inicial corresponde a 100%, é ERRADO afirmar que
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

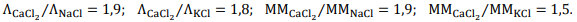
Com base nessas informações, assinale a opção CORRETA entre as condutividades das soluções.
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

I. O comprimento de ligação e a energia de ligação são influenciados pela multiplicidade da ligação, pela ressonância e pelo raio atômico. II. Cargas formais consideram ligações químicas perfeitamente covalentes ao assumir que os elétrons são igualmente compartilhados. III. O poder de polarização de um cátion é maior quanto maiores forem o seu volume e a sua carga. A interação deste cátion com um ânion altamente polarizável tende a apresentar um maior caráter covalente. IV. Na ressonância há uma diminuição da energia em função da contribuição de estruturas que possuem a mesma geometria, porém com diferentes arranjos dos elétrons.
Das afirmações acima, está(ão) ERRADA(S) apenas