Questões Militares
Foram encontradas 503 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
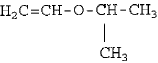
A cadeia acima pode ser classificada como:
A retina do olho humano contém dois tipos de células especializadas: os cones e os bastonetes. Nos bastonetes acontece uma transformação química fundamental para a química da visão. Trata-se da conversão do retinol (Vitamina A) em retinal que, na sequência, sofrerá outras transformações.
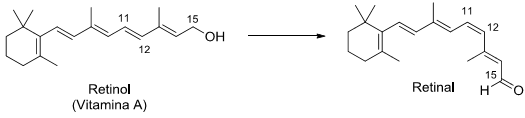
Sobre o tema, considere as seguintes afirmativas:
1. O grupo funcional álcool no retinol é convertido a aldeído no retinal.
2. A ligação dupla entre os carbonos 11 e 12 sofre uma reação de isomerização.
3. A molécula do retinal apresenta um grau de oxidação superior ao do retinol.
4. A molécula do retinol apresenta um centro quiral no carbono 15.
Assinale a alternativa correta.
O salicilato de metila é um produto natural amplamente utilizado como analgésico tópico para alívio de dores musculares, contusões etc. Esse composto também pode ser obtido por via sintética a partir da reação entre o ácido salicílico e metanol, conforme o esquema abaixo:
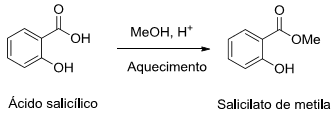
A reação esquematizada é classificada como uma reação de:
O palito de fósforo é um dos artigos mais úteis no nosso cotidiano. Na sua composição, possui fósforo vermelho, enxofre e clorato de potássio. A cabeça de um palito de fósforo pesa aproximadamente 0,05 g. A reação que ocorre na queima da cabeça de fósforo está representada a seguir:
3 P4 + S + 10 KClO3 + O2 → 3 P4O10 + 10 KCl + SO2
O cheiro característico de “fósforo queimado” se deve ao dióxido de enxofre formado.
Dados: No palito de fósforo, os componentes estão em quantidades estequiométricas. M (g mol-1): Cl = 35,5; K = 39; O= 16;P = 31; S = 32.
A massa (em g) de dióxido de enxofre produzido ao queimar uma cabeça de fósforo é aproximadamente:
“Gelo de fogo” escondido em permafrost é fonte de energia do futuro? Conhecido como "gelo que arde", o hidrato de metano consiste em cristais de gelo com gás preso em seu interior. Eles são formados a partir de uma combinação de temperaturas baixas e pressão elevada e são encontrados no limite das plataformas continentais, onde o leito marinho entra em súbito declive até chegar ao fundo do oceano. Acredita-se que as reservas dessa substância sejam gigantescas. A estimativa é de que haja mais energia armazenada em hidrato de metano do que na soma de todo petróleo, gás e carvão do mundo. Ao reduzir a pressão ou elevar a temperatura, a substância simplesmente se quebra em água e metano – muito metano. Um metro cúbico do composto libera cerca de 160 metros cúbicos de gás a pressão e temperatura ambiente, o que o torna uma fonte de energia altamente intensiva.
Disponível em: http://www.bbc.co.uk/portuguese/noticias/2014/04/140421_energia_metano_ms.shtml.
Acessado em 21/04/2014. Texto adaptado.
Dado: R = 8,2 x 10-5 m3 atm K-1 mol-1
Para armazenar todo o gás do interior de 1 m3 de “gelo de fogo” num cilindro de 1 m3 e a temperatura de 0°C, é necessária uma pressão (em atm) de