Questões Militares
Para aluno do ita
Foram encontradas 869 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Em um triângulo equilátero ABC de lado 2, considere os pontos P, M e N pertencentes
aos lados 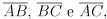 respectivamente, tais que
respectivamente, tais que
a) P é o ponto médio de 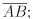
b) M é o ponto médio de 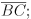
c) P N é a bissetriz do ângulo 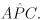
Então , o comprimento do segmento 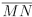 é igual a
é igual a
Considere o polinômio p com coeficientes complexos definido por
p(z) = z4 + (2 + i)z3 + (2 + i)z2 + (2 + i)z + (1 + i).
Podem os afirmar que
Seja ABC um triângulo equilátero e suponha que M e N são pontos pertencentes ao lado 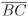 tais que BM = MN = NC. Sendo α a medida, em radianos, do ângulo MÂN, então o valor de cos α é
tais que BM = MN = NC. Sendo α a medida, em radianos, do ângulo MÂN, então o valor de cos α é
Seja p o polinômio dado por p(x) = x8 + xm — 2xn, em que os expoentes 8,m,n formam , nesta ordem , uma progressão geométrica cuja soma dos termos é igual a 14. Considere as seguintes afirmações:
I. x = 0 é uma raiz dupla de p.
II. x = 1 é uma raiz dupla de p.
III. p tem quatro raízes com parte imaginária não nula.
Destas, é (são) verdadeira(s)
Sejam λ um a circunferência de raio 4 cm e 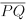 uma corda em λ de comprimento 4 cm. As tangentes a λ em P e em Q interceptam -se no ponto R exterior a λ. Então, a área do triângulo PQR, em cm2, é igual a
uma corda em λ de comprimento 4 cm. As tangentes a λ em P e em Q interceptam -se no ponto R exterior a λ. Então, a área do triângulo PQR, em cm2, é igual a
I. Se z e w são números complexos tais que z — iw = 1 — 2i e w — z = 2 + 3i, então z2+ w2 = — 3 + 6i.
II. A soma de todos os números complexos z que satisfaz em
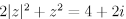 é igual a zero.
é igual a zero.
III. Se z = 1 — i, então z59 = 229(—1 + i).
É (são) verdadeira(s)
Se 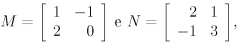 então M NT — M-1N é igual a
então M NT — M-1N é igual a
Um triângulo retângulo tem perímetro igual a 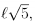 em que l é o comprimento da hipotenusa. Se α e β são seus ângulos agudos, com α < β então sen(β — α) é igual a
em que l é o comprimento da hipotenusa. Se α e β são seus ângulos agudos, com α < β então sen(β — α) é igual a
Se o sistema de equações
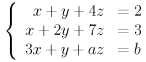
é impossível, então os valores de a e b são tais que
Um triângulo está inscrito numa circunferência de raio 1 cm. O seu maior lado mede 2
cm e sua área é de 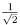 cm2. Então, o menor lado do triângulo, em cm, mede
cm2. Então, o menor lado do triângulo, em cm, mede
Seja Pn um polígono convexo regular de n lados, com n > 3. Considere as afirmações a seguir:
I. Pn é inscritível numa circunferência.
II. Pn é circunscritível a uma circunferência.
III. Se ln é o comprimento de um lado de Pn e an é o comprimento de um apótema de Pn, então
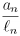
 < 1 para todo n > 3.
< 1 para todo n > 3.
É (são) verdadeira(s)
I. A sequência (an) é decrescente.
II. an > 0 para todo n > 1.
III. an < 1 para todo n > 3.
É (são) verdadeira(s)
Se tgx = √7 e x ∈ [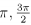 ], então sen3x é igual a
], então sen3x é igual a
Se x é um número natural com 2015 dígitos, então o número de dígitos da parte inteira
de 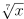 é igual a
é igual a
I. A função f (x ) = log10 (
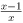 ) é estritamente crescente no intervalo ]1, + ∞ [.
) é estritamente crescente no intervalo ]1, + ∞ [.II. A equação 2x+2 = 3x-1 possui uma única solução real.
III. A equação (x + 1)x = x admite pelo menos uma solução real positiva.
É (são) verdadeira(s)
