Questões Militares
Nível médio
Foram encontradas 45.670 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
“Desta vez, o muro não era alto, e a espiga era baixinha; bastava esticar o braço com algum esforço, para arrancá-la do pé. Rangel andava neste trabalho desde alguns meses. Não esticava o braço sem espiar primeiro para todos os lados, a ver se vinha alguém, e, se vinha alguém, disfarçava e ia-se embora.” (Machado de Assis)
Quantas orações subordinadas substantivas há no texto acima?
Leia o texto abaixo e avalie as afirmações.
“Aquele rio
era como um cão sem plumas.
Nada sabia da chuva azul,
da fonte cor-de-rosa,
da água do copo de água,
da água de cântaro,
dos peixes de água,
da brisa na água.” (João Cabral de Melo Neto)
I- “de água”, “de cântaro” e “sem plumas” são locuções adjetivas.
II- “azul” e “cor-de-rosa” são adjetivos.
III- “da água”, “de água” e “na água” são locuções adjetivas.
IV- “da fonte” e “dos peixes” são locuções adjetivas.
Está correto o que se afirma em
O trote é uma atividade lúdica em que _______ ser preservada a intimidade e a honra dos calouros. Os abusos que, esporadicamente, _______ não podem justificar que se _______ uma norma rígida para _______ essa prática tradicional nas universidades.
“Se você vier me perguntar por onde andei No tempo em que você sonhava De olhos abertos lhe direi Amigo eu me desesperava” (Belchior)
Durante a conversa sobre o livro a ser editado, Wálter advertiu que os custos talvez o inviabilizassem. Edwalds ponderou que os benefícios é que deveriam ser destacados. Douglas, o mais sensato do grupo, preferiu não opinar. Por que ficar discutindo coisas particulares? Já Eduardo achou que a ideia era digna de ser levada adiante.
Há um discurso indireto livre no segmento referente a
“E todo aquele retintim de ferramentas, e o martelar da forja, e o coro dos que lá em cima brocavam a rocha para lançar-lhe fogo, e a surda zoada de longe, que vinha do cortiço, como de uma aldeia alarmada; tudo dava a ideia de uma atividade feroz, de uma luta de vingança e de ódio.” (Aluísio Azevedo)
As palavras em destaque no texto acima são formadas, respectivamente, pelos processos de
O pastor e a princesa
Carlos Heitor Cony
Um jovem pastor, de cabelos louros e cacheados (façamos uma homenagem ao lugar-comum), andava pela floresta quando, de repente, ao atravessar uma clareira, viu enorme e formoso castelo.
E, na torre mais alta, uma linda princesa de tranças também louras e olhar sonhador. Os dois se olharam e, a partir daquele momento, todas as tardes, o pastor ia à clareira e ficava olhando a princesa, que também olhava pra ele.
Ele suspirava, sabendo que jamais poderia entrar no castelo e ver de perto a princesa. Eis que, um dia, encontrou uma velha na floresta carregando pesado feixe de lenha. O jovem pastor a ajudou, e a velha logo se transformou numa fada e disse que realizaria qualquer pedido dele.
“Quero ser um príncipe para entrar naquele castelo!”, pediu o pastor. A fada advertiu-o de que realizaria o seu desejo, mas que ele jamais poderia voltar a ser o que era. O jovem foi em frente. Seria um absurdo voltar a ser pastor.
Logo as fanfarras do castelo soaram para o príncipe que se aproximava. A corte recebeu o visitante com banquetes, desfiles, torneios e todas as homenagens. O rei gostou tanto do príncipe que lhe ofereceu a mão de sua filha.
Louco de alegria, o jovem aceitou e quis beijar a princesa. Ela recusou o beijo. Disse que não poderia casar com o príncipe porque estava apaixonada por um pastor louro de cabelos cacheados que, todas as tardes, costumava aparecer na clareira na floresta. A ele, dera seu coração e somente a ele amaria.
Não sei se inventei ou se li em algum canto essa história cheia de lugares-comuns. Não importa. Não sou jovem nem pastor, não tenho cabelos louros e cacheados. Mas, todas as tardes, continuo indo à floresta para ver se me acontece alguma coisa.
O harém das bananeiras – Editora Objetiva - 1999
O pastor e a princesa
Carlos Heitor Cony
Um jovem pastor, de cabelos louros e cacheados (façamos uma homenagem ao lugar-comum), andava pela floresta quando, de repente, ao atravessar uma clareira, viu enorme e formoso castelo.
E, na torre mais alta, uma linda princesa de tranças também louras e olhar sonhador. Os dois se olharam e, a partir daquele momento, todas as tardes, o pastor ia à clareira e ficava olhando a princesa, que também olhava pra ele.
Ele suspirava, sabendo que jamais poderia entrar no castelo e ver de perto a princesa. Eis que, um dia, encontrou uma velha na floresta carregando pesado feixe de lenha. O jovem pastor a ajudou, e a velha logo se transformou numa fada e disse que realizaria qualquer pedido dele.
“Quero ser um príncipe para entrar naquele castelo!”, pediu o pastor. A fada advertiu-o de que realizaria o seu desejo, mas que ele jamais poderia voltar a ser o que era. O jovem foi em frente. Seria um absurdo voltar a ser pastor.
Logo as fanfarras do castelo soaram para o príncipe que se aproximava. A corte recebeu o visitante com banquetes, desfiles, torneios e todas as homenagens. O rei gostou tanto do príncipe que lhe ofereceu a mão de sua filha.
Louco de alegria, o jovem aceitou e quis beijar a princesa. Ela recusou o beijo. Disse que não poderia casar com o príncipe porque estava apaixonada por um pastor louro de cabelos cacheados que, todas as tardes, costumava aparecer na clareira na floresta. A ele, dera seu coração e somente a ele amaria.
Não sei se inventei ou se li em algum canto essa história cheia de lugares-comuns. Não importa. Não sou jovem nem pastor, não tenho cabelos louros e cacheados. Mas, todas as tardes, continuo indo à floresta para ver se me acontece alguma coisa.
O harém das bananeiras – Editora Objetiva - 1999
O pastor pediu para a fada transformá-lo em um
príncipe para ele poder entrar no castelo porque
O pastor e a princesa
Carlos Heitor Cony
Um jovem pastor, de cabelos louros e cacheados (façamos uma homenagem ao lugar-comum), andava pela floresta quando, de repente, ao atravessar uma clareira, viu enorme e formoso castelo.
E, na torre mais alta, uma linda princesa de tranças também louras e olhar sonhador. Os dois se olharam e, a partir daquele momento, todas as tardes, o pastor ia à clareira e ficava olhando a princesa, que também olhava pra ele.
Ele suspirava, sabendo que jamais poderia entrar no castelo e ver de perto a princesa. Eis que, um dia, encontrou uma velha na floresta carregando pesado feixe de lenha. O jovem pastor a ajudou, e a velha logo se transformou numa fada e disse que realizaria qualquer pedido dele.
“Quero ser um príncipe para entrar naquele castelo!”, pediu o pastor. A fada advertiu-o de que realizaria o seu desejo, mas que ele jamais poderia voltar a ser o que era. O jovem foi em frente. Seria um absurdo voltar a ser pastor.
Logo as fanfarras do castelo soaram para o príncipe que se aproximava. A corte recebeu o visitante com banquetes, desfiles, torneios e todas as homenagens. O rei gostou tanto do príncipe que lhe ofereceu a mão de sua filha.
Louco de alegria, o jovem aceitou e quis beijar a princesa. Ela recusou o beijo. Disse que não poderia casar com o príncipe porque estava apaixonada por um pastor louro de cabelos cacheados que, todas as tardes, costumava aparecer na clareira na floresta. A ele, dera seu coração e somente a ele amaria.
Não sei se inventei ou se li em algum canto essa história cheia de lugares-comuns. Não importa. Não sou jovem nem pastor, não tenho cabelos louros e cacheados. Mas, todas as tardes, continuo indo à floresta para ver se me acontece alguma coisa.
O harém das bananeiras – Editora Objetiva - 1999
Por que as expressões “lugar-comum” e “lugares-
-comuns” aparecem, respectivamente, no primeiro e no
último parágrafos do texto?

I. A adição de um soluto não volátil a um solvente puro, em uma dada temperatura constante, sempre provoca uma diminuição na pressão de vapor.
II. A pressão de vapor de uma solução formada por dois líquidos voláteis é sempre menor que a pressão de vapor dos líquidos puros a uma mesma temperatura.
III. O valor absoluto do abaixamento no ponto de congelamento de uma solução é menor se o soluto dimeriza parcialmente no solvente, comparado ao sistema nas mesmas condições em que não há a dimerização do soluto.
IV. A pressão osmótica é a pressão exercida pelas moléculas de soluto numa membrana semipermeável.
V. Uma mistura formada por duas substâncias nunca solidifica inteiramente em uma única temperatura.
Assinale a opção que contém a(s) afirmação(ões) CORRETA(S):

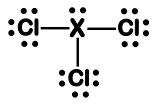
I. A molécula adota uma estrutura trigonal plana, com ângulo de ligação Cl-X-Cl maior ou igual a 120°.
II. A molécula adota uma estrutura tetraédrica, com ângulo de ligação Cl-X-Cl maior que 109,5°.
III. O átomo “X” pode ser o nitrogênio, preservando a geometria molecular. IV. O átomo “X” pode ser o boro, preservando a geometria molecular.
Assinale a opção que contém a(s) afirmação(ões) CORRETA(S):


I. Um processo termodinâmico é definido pelo estado final e estado inicial do sistema.
II. ∆T é sempre nula em um processo isotérmico.
III. A troca de calor envolvida em um processo isotérmico deve ser nula (q = 0).
IV. Todo processo em que ∆T = 0 é um processo isotérmico.
V. ∆T = 0 para todo processo em sistema isolado.
Assinale a opção que contém as afirmações ERRADAS:

I. A reação do metil benzeno com o ácido sulfúrico fumegante é mais rápida comparada à reação do benzeno nas mesmas condições experimentais.
II. A reação de nitração do metil benzeno produz preferencialmente compostos orto- e parasubstituídos.
III. A nitração do benzeno é mais rápida do que a nitração do nitrobenzeno, a qual requer uma maior concentração de ácido nítrico e uma temperatura maior.
IV. O único produto resultante da reação de nitração do 1-hidroxi-4-metil-benzeno é o 1-hidroxi-2-nitro4-metil-benzeno.
V. A reação de nitração do ácido benzoico produz preferencialmente o composto meta-substituído.
Assinale a opção que contém as afirmações CORRETAS:

2A + B ⇆ C + D + Q
em que A e B são reagentes, C e D os produtos e Q o calor liberado. Avalie as seguintes suposições sobre o efeito das modificações de um parâmetro da reação, mantendo os outros constantes.
I. Conduzir a reação a 600 °C gera uma fração maior de C e D.
II. Conduzir a reação a 600 °C faz com que o equilíbrio seja alcançado em menos de 60 min.
III. Conduzir a reação a uma pressão de 100 atm gera uma fração menor de C e D.
IV. Remover C e D do meio reacional após o equilíbrio e então retomar a reação permitem obter uma fração total maior de C e D.
Escolha a opção que lista a(s) afirmação(ões) CORRETA(S).


Experimentos foram realizados, bombardeando cada material com uma quantidade de partículas a e registrando o número de partículas coletadas em cada detector, conforme a tabela abaixo.
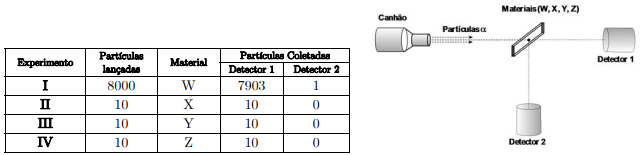
A partir dessas informações, assinale a alternativa que apresenta a conclusão CORRETA sobre as observações feitas nos experimentos.