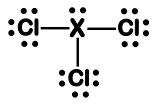
Considere a estrutura de Lewis de um tricloreto. São feitas ...

I. A molécula adota uma estrutura trigonal plana, com ângulo de ligação Cl-X-Cl maior ou igual a 120°.
II. A molécula adota uma estrutura tetraédrica, com ângulo de ligação Cl-X-Cl maior que 109,5°.
III. O átomo “X” pode ser o nitrogênio, preservando a geometria molecular. IV. O átomo “X” pode ser o boro, preservando a geometria molecular.
Assinale a opção que contém a(s) afirmação(ões) CORRETA(S):
- Gabarito Comentado (1)
- Aulas (2)
- Comentários (1)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
I & II - Falsas, a geometria apresentada é a piramidal, pois apresentamos quatro átomos, onde nosso átomo central contém, no mínimo, cinco elétrn na camada de valência, o átomo central está ligado a três outros átomos nas extremidades.
III - Está correta, pois de acordo com a representação dá-se a entender que o átomo X, ele necessita de 3 eletrons para se estabilizar, como está ali ele fazendo uma ligação covalente com os átomos de Cloro, por isso poderia ser o Nitrogênio, pois o Nitrogênio para se estabilizar ele necessita de 3 elétrons.
IV - Está incorreta, pois o Boro ele necessita de 5 elétrons para se estabilizar e não somente 3 como representado no desenho
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo