Questões Militares
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 151 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A seguinte reação não-balanceada e incompleta ocorre em meio ácido:
(Cr2O7 )-2 + (C2 O4)-2 → Cr3+ + CO2
A soma dos coeficientes estequiométricos da reação completa e balanceada é igual a
CrI3 + Cl2 + NaOH → NaIO4 + Na2CrO4 + NaCl + H2O
Assinale a alternativa que indica a soma dos menores coeficientes inteiros capazes de balancear a equação química acima:
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
A taxa de emissão de dióxido de carbono em função do consumo médio de certo combustível, em um carro de testes, é apresentada a seguir.
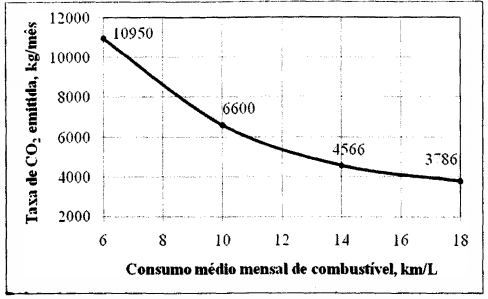
Para um consumo médio de 10 km/L, a massa total mensal de combustível consumida é 2175
kg. Dentre as opções abaixo, pode-se afirmar que o combustível testado foi o:
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
A chuva ácida é um fenômeno químico resultante do contato entre o vapor de água existente no ar, o dióxido de enxofre e os óxidos de nitrogênio. O enxofre é liberado, principalmente, por veículos movidos a combustível fóssil; os óxidos de nitrogênio, por fertilizantes. Ambos reagem com o vapor de água, originando, respectivamente, os ácidos sulfuroso, sulfídrico, sulfúrico e nítrico.
Assinale a opção que apresenta, respectivamente, a fórmula desses ácidos.
Quantos gramas estão contidos em um mol das moléculas H2S04 (ácido sulfúrico), Ca(OH)2 (hidróxido de cálcio), e C12H22O11 (sacarose) , respectivamente?
Uma amostra de 1,72 g de sulfato de cálcio hidratado (CaSO4 · n H2O), onde “n” representa o número de molécula(s) de água (H2O), é aquecida até a eliminação total da água de hidratação, restando uma massa de 1,36 g de sulfato de cálcio anidro.

A fórmula molecular do sal hidratado é:
Analise as afirmações I, II, III e IV abaixo referente(s) à(s) característica(s) e/ou informação(ões) sobre algumas substâncias, nas condições ambientes:
I- A substância é a principal componente do sal de cozinha e pode ser obtida pela evaporação da água do mar. Dentre seus muitos usos podemos citar: a produção de soda cáustica e a conservação de carnes.
II- A substância é classificada como composta, e pode fazer parte da chuva ácida. Dentre seus muitos usos, podemos citar: utilização em baterias de automóveis e na produção de fertilizantes, como o sulfato de amônio.
III-A substância em solução aquosa é vendida em drogarias e utilizada como antisséptico e alvejante. Algumas pessoas utilizam essa substância para clarear pelos e cabelos.
IV-A substância é classificada como simples, tem seu ponto de ebulição igual a -195,8 ºC, é a mais abundante no ar atmoférico e reage com o gás hidrogênio produzindo amônia.
As substâncias que correspondem às afirmações I, II, III e IV são, respectivamente,
Um professor de Química, durante uma aula experimental, pediu a um de seus alunos que fosse até o armário e retornasse trazendo, um por um, nesta ordem: um oxiácido inorgânico; um diácido; um sal de metal alcalino; uma substância que, após aquecimento, pode gerar dióxido de carbono (CO2(g)); e um sal ácido.
Assinale a alternativa que corresponde à sequência de fórmulas moleculares que atenderia corretamente ao pedido do professor.
Na equação da reação de óxido-redução, representada no quadro abaixo, a soma dos menores coeficientes estequiométricos inteiros, necessários para balanceá-la, e o agente redutor são, respectivamente,

O fósforo branco é uma das formas alotrópicas do fósforo e foi usado durante a Primeira e a Segunda Guerras Mundiais como componente de munição incendiária capaz de causar terríveis queimaduras e problemas respiratórios.
Assinale a característica abaixo referente ao fósforo branco
Dada a seguinte equação iônica de oxidorredução da reação, usualmente utilizada em etapas de sínteses químicas, envolvendo o íon dicromato (Cr2O72-) e o ácido oxálico (H2C2O4):
Cr2O72- + H2C2O4 + H+→ + Cr3+ + CO2 + H2O
Considerando a equação acima e o balanceamento de equações químicas por oxidorredução,
a soma total dos coeficientes mínimos e inteiros obtidos das espécies envolvidas e a substância
que atua como agente redutor são, respectivamente,
( ) Após o balanceamento da equação Na2CO3(s) + FeCr2O4(s) + O2(g)→ Fe2O3(s) + Na2CrO4(s) + CO2(g), a soma dos coeficientes mínimos e inteiros das espécies químicas envolvida é 17.
( ) Na reação entre nitrato de prata e brometo de potássio dissolvidos em água, o produto que forma cristais insolúveis em água é KNO2.
( ) A queima do gás amônia produz dióxido de nitrogênio e água.
( ) Após o balanceamento da equação NH3(g) + O2(g)→ NO(g) + H2O(g), a soma de todos os coeficientes mínimos e inteiros das espécies químicas envolvidas é 19.
A sequência está correta em
Associe corretamente as fórmulas aos nomes de suas respectivas substâncias e, a seguir, assinale a opção que apresenta a sequência correta.
FÓRMULAS
I - HclO
II - Cu (OH)2
III - P2O5
IV - BaSO4
V - MnO2
VI — CaC2O4
SUBSTÂNCIAS
( ) Pentóxido de difósforo.
( ) Óxido de magnésio.
( ) Sulfato de bário.
( ) Ácido hipocloroso.
( ) Hidróxido de cobre (II)
( ) Dióxido de manganês.
( ) Ácido cloroso.
( ) Oxalato de cálcio.
O fosfato de cálcio, Ca3(PO4)2, ê um dos compostos utilizados recentemente em pesquisas na obtenção de cimento ortopédico. A reação entre o óxido de cálcio com ácido fosfórico é uma das formas de obtenção do Ca3(PO4)2.
Assinale a opção que representa a reação química balanceada
de obtenção do fosfato de cálcio a partir de óxido de cálcio
e ácido fosfórico.
