Questões Militares
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 151 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Solução do frasco I: ficou rosa em fenolftaleína e amarela no metilorange.
Solução do frasco II: permaneceu incolor em fenolftaleína e vermelha no metilorange.
Solução do frasco III: permaneceu incolor em fenolftaleína e amarela no metilorange.
Sabe-se que a fenolftaleína, em pH acima de 9 apresenta coloração vermelha, enquanto que, em pH abaixo desse valor, é incolor. Sabe-se ainda que o metilorange apresenta coloração vermelha em pH abaixo de 3,5 e amarela em pH acima deste valor.
Sendo assim, os estudantes chegaram à conclusão de que os frascos I, II e III contêm, respectivamente, solução de

Dados: M(g/mol): C = 12, S = 32; O = 16, N = 14, K = 39
Para formular uma mistura baseada na estequiometria da reação, a proporção em massa dos constituintes enxofre, carvão vegetal e salitre na mistura deve ser, respectivamente:
C3H5(ONO2)3(ℓ)→N2(g)+CO2(g)+O2(g)+H2O(g)
Qual o volume aproximado de gás formado, ao nível do mar e a 27ºC, quando 2,27g da dinamite reagem?
I. As proporções molares com que os produtos são formados. II. Que a reação pode ocorrer. III. Que a reação é exotérmica. IV. A espontaneidade da reação. V. As fórmulas dos produtos.
(Massa molar: Mg = 24,31 g/mol)
I - H2Cr20,
II - Cr03
III- NH4OH
IV - BaO
V - NaHS03
VI - ZnO
Acerca dessas fórmulas é correto afirmar que, quando dissolvidas pequenas quantidades em água destilada, as substâncias:
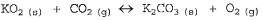
0 dióxido de carbono gerado pela tripulação dos submarinos deve ser constantemente removido do ar e o gás oxigênio, recuperado. Grupos de projetistas de submarinos desenvolveram uma célula purificadora de ar, contendo superóxido de potássio, KO2, que reage com o dióxido de carbono, formando carbonato de potássio e liberando oxigênio, de acordo com a equação química NÃO balanceada acima. Assinale a opção que apresenta a soma dos menores coeficientes estequiométricos inteiros dos compostos gasosos nessa equação, depois de balanceada.
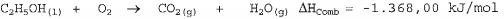
Sabendo-se que na combustão de certa quantidade de etanol houve a liberação de 456,00 kJ, é correto afirmar que a quantidade de oxigênio consumida na reação foi de:
CH4(g) + 2 O2(g) ->CO2(g) + 2 H2O(g) ΔH = -802 kJ
Se utilizarmos 4 mol de CH4 e 4 mol de O2 para uma nova reação, a quantidade de calor liberada será de
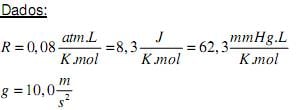
Cu (s) + HNO3 (aq) → Cu(NO3)2 (aq) + NO (g) + H2O (l)
Após o balanceamento da equação com os coeficientes estequiométricos (menores números inteiros) a soma destes coeficientes será igual a
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a
Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro
preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro
(Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2 (g) COCl2 (g).
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro (Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2(g) → COCl2 (g).
Em um reator foram dispostos 560 g de monóxido de carbono e 355 g de cloro. Admitindo-se a reação entre o monóxido de carbono e o cloro com rendimento de 100 % da reação e as limitações de reagentes, a massa de fosgênio produzida é de
Dados:
- massas atômicas: C = 12 u ; Cl = 35,5 u; O = 16 u
