Questões de Concurso
Sobre química em ciências
Foram encontradas 479 questões
Fonte: Ricklefs, R.E. A Economia da Natureza. Quinta edição. Rio de Janeiro: Editora Guanabara Koogan, 2003.
Sobre esse processo, julgue os itens a seguir como Verdadeiros (V) ou Falsos (F):
(__)Numa escala global, a dissolução e a precipitação aproximadamente se equilibram entre si, embora sob algumas condições a precipitação pode ser favorecida, tal como no passado pela deposição de carbonato de cálcio.
(__)Esse processo de reciclagem do carbono ocorre somente em sistemas aquáticos.
(__)A troca entre sedimentos e a coluna d'água é extremamente importante para a reciclagem do carbono de curto prazo no ecossistema.
Assinale a alternativa CORRETA com a sequência de cima para baixo.
Fonte: Fonseca, Albino. Ciências, 9° ano. 3. ed. São Paulo: IBEP, 2013.
A reação do exemplo é denominada:
I.As partículas desviadas da trajetória eram aquelas que se chocavam contra o núcleo ou que passavam perto dele.
II.Que as cargas positivas estavam espalhadas por todo átomo.
III.Que não haviam muitos espaços vazios dentro do átomo.
É CORRETO o que se verifica em:
I. A massa atômica do hidrogênio é aproximadamente 1 u.
II. A massa atômica do oxigênio é aproximadamente 16 u.
III. A massa atômica do carbono é aproximadamente 12 u.
Assinale a opção que apresenta a informação CORRETA.
Os polímeros são categorizados principalmente em duas classes: plásticos e elastômeros. Os plásticos, que são tipos de resinas orgânicas __________, podem ser encontrados naturalmente ou serem __________, e são geralmente fabricados através de um processo conhecido como __________. Estes materiais são essenciais na engenharia por diversas razões, incluindo a vasta gama de propriedades que possuem e, na maioria das vezes, o seu custo relativamente __________.
Assinale a opção que preenche CORRETA e respectivamente as lacunas.
Sabendo disso, assinale a fórmula CORRETA que representa a reação de fotossíntese em bactérias fotossintetizantes
Quais são os elementos principais e quais são os secundários?
“Assim como as letras formam um alfabeto, o corpo humano é composto por diferentes níveis de organização, como o nível químico, o nível tecidual e o nível de sistemas.”
Qual alternativa descreve corretamente cada um desses níveis, na ordem mencionada?
Observe a tabela a seguir:
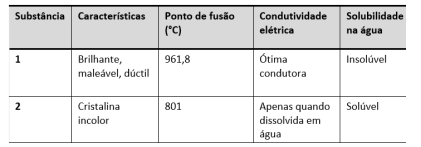
As duas substâncias acima foram testadas e classificadas como sólidos metálicos ou iônicos. Delas, a substância iônica é a
O professor forneceu aos alunos um béquer graduado com 100mL de água. Os alunos, depois de colocarem a estátua na água, observaram que o líquido subiu no béquer pra 130mL.
Depois de realizarem alguns cálculos, os alunos responderam, corretamente, que a densidade do metal corresponde a
“Além do ________ não há elementos pesados que ocorram naturalmente na Terra; eles precisam ser sintetizados”
Fonte: BBC Brasil (2018)
Completa corretamente a lacuna do trecho acima: