Questões de Concurso
Sobre química em ciências
Foram encontradas 479 questões
Os elementos químicos são um conjunto de átomos que possuem o mesmo número atômico, isso lhes conferem as mesmas propriedades químicas.
Fonseca, Albino. Ciências, 9° ano. 3. ed. São Paulo: IBEP, 2013.
Cerca de 40% do corpo são compostos por músculo esquelético, e aproximadamente outros 10% por músculo liso e cardíaco. Alguns dos princípios básicos da contração se aplicam a todos esses diferentes tipos de músculos.
Hall, John E. (John Edward). Tratado de fisiologia médica / John E.
Hall. - 13. ed. - Rio de Janeiro: Elsevier, 2017
Segundo a Lei de Boyle, a pressão de um gás é inversamente proporcional ao seu volume a uma temperatura constante (P ∝ 1/V); a Lei de Charles estabelece que o volume de um gás é diretamente proporcional à sua temperatura em Kelvin a pressão constante (V ∝ T); e a Lei dos Gases Combinados combina essas relações em uma única equação (PV = nRT), onde P é a pressão, V é o volume, n é a quantidade de substância em moles, R é a constante dos gases ideais e T é a temperatura em Kelvin.
A organização dos elementos na Tabela Periódica, em ordem crescente de número atômico, é fundamental para identificar padrões periódicos nas propriedades químicas e físicas dos elementos, refletindo a tendência de comportamentos análogos em grupos ou famílias específicas.
A decomposição microbiológica da matéria orgânica representa um processo essencial no ciclo biogeoquímico do carbono, no qual microrganismos heterotróficos desempenham um papel preponderante na mineralização de compostos orgânicos em dióxido de carbono (CO2).
A energia nuclear é produzida através da fissão nuclear, na qual núcleos pesados como o urânio-235 são bombardeados por nêutrons, levando à quebra desses núcleos em fragmentos menores, liberando uma enorme quantidade de energia e mais nêutrons que podem iniciar uma reação em cadeia.
A disposição dos elementos na Tabela Periódica reflete relações sistemáticas entre propriedades, como afinidade eletrônica, capacidade de formar íons e comportamento de ligação química. A variação das propriedades ao longo de um período ou dentro de um grupo está intrinsecamente ligada à estrutura eletrônica dos átomos. A interpretação da configuração eletrônica permite predizer tendências como raio atômico, eletronegatividade e reatividade química, fornecendo insights valiosos para o entendimento e aplicação da química moderna.
O modelo atômico proposto por Niels Bohr, em 1913, introduziu a ideia de que os elétrons orbitam o núcleo atômico em camadas ou níveis de energia discretos. Segundo esse modelo, os elétrons podem saltar entre essas camadas mediante a absorção ou emissão de energia, resultando na emissão de luz discreta que observamos em espectros atômicos.
A fotossíntese é um processo bioquímico fundamental no ciclo biogeoquímico do oxigênio, no qual organismos autotróficos convertem dióxido de carbono (CO2) e água (H2O) em carboidratos e oxigênio molecular (O2) utilizando energia solar capturada pela clorofila.
Analise as asserções abaixo:
I. O ozônio (O3) é uma forma molecular de oxigênio altamente reativa como oxidante, capaz de oxidar quimicamente moléculas orgânicas e obstruir seu funcionamento adequado. Consequentemente,
II. O ozônio é tóxico para a vida animal, mesmo em
baixas concentrações, mas para os vegetais ele é
facilmente absorvido, inclusive aumentando a eficiência
energética vegetal.
Fonte: Ricklefs, R.E. A Economia da Natureza.
Quinta edição. Rio de Janeiro: Editora Guanabara
Koogan, 2003 (modificado).
A partir da análise dessas asserções, é possível AFIRMAR que:
O solo é o resultado de um paciente trabalho da natureza. Partículas (minerais e orgânicas) vão sendo depositadas em camadas (horizontes) devido à ação da chuva, do vento, do calor, do frio e de organismos (fungos, bactérias, minhocas, formigas e cupins) que vão desgastando as rochas de forma lenta no relevo da terra.
Fonte: Embrapa.
Abaixo estão os elementos essenciais do solo, os chamados macronutrientes, EXCETO:
I. Água II. Gás Hélio III. Álcool comum IV. Ácido clorídrico V. Ar que respiramos VI. Água e óleo
Assinale a alternativa CORRETA.
Além disso, os filtros também combatem a presença de chumbo, em 95% e o parasita Criptosporidiose, em 99%, que pode causar diarreias e infecções intestinais.
Disponível em: https://www.gov.br/fundaj/pt‑br/ destaques/observa‑fundaj‑itens/observa‑fundaj/ tecnologias‑de‑convivencias‑com‑as‑secas/ filtro‑de‑barro‑brasileiro‑e‑considerado‑o‑melhor‑do‑mundo‑1. Acesso em: 9 maio 2024.
O principal processo envolvido na filtragem do sistema de purificação descrito nesse texto é a
Qual é a partícula subatômica responsável pela determinação das propriedades químicas de um elemento?
A história da química é marcada por uma evolução contínua desde a alquimia até a química moderna. Este percurso envolveu a sistematização dos elementos, a descoberta de novas substâncias e o desenvolvimento de teorias que explicam as reações químicas. Considere a evolução do conceito de elemento químico e a classificação periódica, bem como a distinção entre misturas, substâncias puras e reações químicas. Com base no desenvolvimento histórico da química, avalie as assertivas abaixo e selecione a alternativa correta:
1. A alquimia, praticada durante o século X, foi crucial para o desenvolvimento de técnicas laboratoriais ainda utilizadas na química hoje em dia. (Principe, 2012).
2. A classificação periódica dos elementos por Mendeleev em 1869 foi baseada na organização dos elementos conforme suas massas atômicas e propriedades químicas semelhantes (Scerri, 2007).
3. Uma mistura é uma combinação de duas ou mais substâncias onde cada uma mantém suas propriedades individuais (Petrucci et al., 2017).
4. Substâncias puras possuem composição fixa e propriedades definidas, podendo ser compostos ou elementos (Zumdahl & Zumdahl, 2020).
5. Reações químicas envolvem a transformação de substâncias reagentes em produtos, com a formação de ligações químicas (Atkins & de Paula, 2017).
Alternativas:
Considere um laboratório de pesquisa onde uma equipe de cientistas está estudando as propriedades físicas e químicas de diferentes materiais. Durante um experimento, foram observadas as seguintes propriedades: densidade, ponto de fusão, reatividade com ácidos, e condutividade elétrica. A equipe também investigou a capacidade dos materiais de formarem ligações covalentes e iônicas.
Com base nessas observações, avalie as assertivas abaixo sobre as propriedades da matéria e selecione a alternativa correta:
1. A densidade é uma propriedade física intensiva que depende da composição do material (Atkins & Jones, 2016).
2. O ponto de fusão é uma propriedade física extensiva que varia de acordo com a quantidade de material (Brown et al., 2018).
3. A reatividade com ácidos é uma propriedade química que pode ser usada para identificar substâncias (Kotz et al., 2019).
4. A condutividade elétrica pode indicar a presença de íons livres ou de elétrons móveis no material (Silberberg, 2020).
5. Materiais que formam ligações covalentes geralmente apresentam baixa condutividade elétrica em estado sólido (Chang, 2017).
Alternativas:
TUBO 1 = com areia;
TUBO 2 = com uma mistura de areia com argila;
TUBO 3 = com argila.
Depois, os três tubos foram colocados emborcados em uma placa de Petri com água.
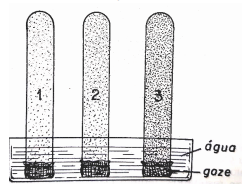
Figura retirada de: Fundação Brasileira para o Desenvolvimento do Ensino de Ciências. Laboratório Básico Polivalente de Ciências para o 1º grau: manual do professor. Rio de Janeiro: FENAME. 1983.
Após algum tempo, ao retirar os tubos de ensaio da água e colocar o conteúdo de cada um deles em cima de um pedaço de papel, é possível perceber e, assim, concluir que: