Questões de Engenharia Química e Química Industrial - Termodinâmica e Equilíbrio de Fases para Concurso
Foram encontradas 492 questões
A entropia molar é uma medida da quantidade de desordem ou Incerteza em um sistema termodinâmico. É uma grandeza termodinâmica que mede a dispersão da energia e a quantidade de informação presente em um sistema. Para cada par apresentado, assinale a alternativa que apresenta as espécies com maior entropia molar a 298K:
I -HBr(g)e HF(g)
II- I2(s) el2(I)
III-Ar (g) a 1atm e Ar (g) a 2atm
A droga cocaína pode ser consumida em diferentes formas de apresentação, dependendo principalmente se a substância se encontra na forma de sal ou base livre e das características físicoquímicas com que ela é comercializada (pedra, pó, pasta; oxidada, adulterada, diluída).
(Fonte: BRUNI, Aline Thais. et al. Fundamentos de Quimica Forense. 2 ed Campinas, SP: Ed. Millenium, 2019.
Abaixo temos a conversão química entre cocaína base livre e o sal de cocaína.
Diante do exposto e considerando sistema em equilíbrio e processo direto com liberação de energia a pressão constante sob forma de calor, assinale a alternativa correta.
A área da Físico-Química conhecida como termodinâmica ocupa-se do estudo das transformações da energia, em particular da transformação de calor em trabalho e vice-versa. Sobre o assunto em questão, é correto afirmar que:
Os compostos de coordenação estão presentes na maioria dos processos químicos que envolvem espécies inorgânicas em temperaturas não muito elevadas. Assim é que em fenômenos vitais como a respiração e a fotossíntese (entre outros), em incontáveis processos industriais importantes no cotidano e em um número incalculável de experimentos de laboratórios, sempre estão envolvidos processos ou produtos relacionados à Quimica de Coordenação.
(Fonte: DE FARIAS, Robson. Química de coordenação: fundamentos e atualidades. 2.ed. Campinas, SP: Ed Atomo, 2009).
Sobre os compostos citados no texto, podemos afirmar que:
Para um sistema fechado em repouso, isso se resume
dU = dQ + dW,
onde, U é energia interna; Q, calor, e W, trabalho. Outra função termodinâmica é a entalpia, H, que está corretamente definida na opção
Cr(OH)3(s) ⇌ Cr3+ (aq) + 3OH- (aq); Kps = 10-30 Cr(OH)3(s) + OH- (aq) ⇌ Cr(OH)- 4 (aq); Ks = 10-0,4
Considerando-se a concentração analítica de cromo de 0,010 mol L-1 , conclui-se que o cromo estará quantitativamente
2 NO2 (g) + ½ O2 (g) + H2 O (g) ⇌ 2 HNO3 (g)
Considere que a reação foi simulada em laboratório, num reator com êmbolo, cujo volume e aquecimento podem ser variados.
É possível deslocar o equilíbrio para formar mais HNO3 , quando
NÃO é adequado para essa finalidade o
Com essas informações, constata-se o seguinte:
A temperatura desejada, em ºC, vale
Com base nessas informações, verifica-se o seguinte:
Cx Hy + y (x + y/4) O2 → x CO2 + y/2 H2 O
Admita a composição molar do combustível Cx Hy em que a razão y/x = 2
Se for empregado O2 com 100% de excesso, então, a razão molar N2 /CO2 esperada na análise do gás de exaustão é, aproximadamente, de
Dado N2 /O2 no ar ≈ 3,7
Associe as características de sistemas fluidos aos processos.
CARACTERÍSTICA
I – redução da concentração molar das espécies
II – aumento da concentração mássica das espécies
III – constância aproximada da fração volumétrica das espécies
IV – aproximação da composição da espécie não volátil na fase gás pela sua pressão de vapor
PROCESSO
P – compressão de gás
Q – bombeamento de um líquido
R – transporte de um combustível por caminhões
S – escoamento de um gás ao longo de um tubo isotérmico
T – armazenamento de um combustível em reservatórios de teto fixo com controle de pressão
As associações corretas são:
• O cilindro A recebe matéria do cilindro B até que o cilindro A atinja 5 atm de pressão. • O cilindro A recebe então matéria do cilindro C até que o cilindro A atinja 10 atm de pressão.
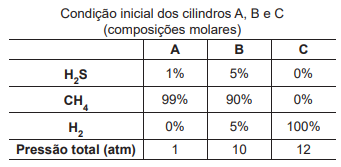
A fração molar de H2 S no cilindro A ao final dos procedimentos é, aproximadamente,
• 700 m3 /dia de óleo (medidos na condição de 300 K) • 12.000 m3 /dia de gás natural (medidos na condição de 300 K, 1 atm)
Considerando-se uma condição de escoamento de 360 K e 15 atm e densidade do líquido constante, a vazão volumétrica total (gás + líquido), em m3 /dia, é, aproximadamente,
Considere o reator de reforma de metano, em fase gasosa, ilustrado na Figura.
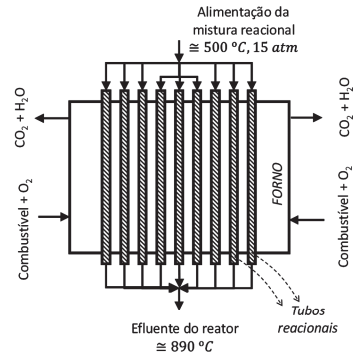
Nesse processo, são admitidas as seguintes reações principais:
CH4 + H2 O ⇌ CO + 3 . H2
CH4 + 2H2
O ⇌ CO2 + 4H2
Sabe-se que a mistura reacional é dividida em diversos reatores menores (tubos reacionais). Como as reações de reforma são endotérmicas, há necessidade de aquecimento, o que é feito pela queima de combustível (geralmente o próprio metano) no forno que envolve os tubos reacionais.
Na condição representada na Figura, a mistura reacional entra a 500ºC e 15 atm e sai a cerca de 890ºC.
Nessas condições, conclui-se que
Seja a equação de estado de Van der Waals para um gás não ideal:
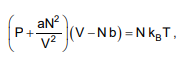
onde: P é a pressão; V, o volume; N, o número de moléculas; T, a temperatura; kB, a constante de Boltzmann; e a e b são constantes.
No Sistema Internacional (SI), as unidades para a e b são,
respectivamente,
Considere as três relações de Maxwell propostas abaixo.
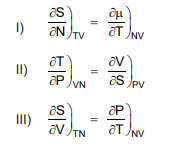
É(são) verdadeira(s) APENAS a(s) relação(ões)
Nesse contexto, o valor W2 /W1 é igual a