Questões de Concurso
Sobre termodinâmica e equilíbrio de fases em engenharia química e química industrial
Foram encontradas 557 questões
Em relação às equações de estado aplicadas aos gases, julgue o item.
Van der Waals e Redlich‑Kwong propuseram
equações distintas que consideram o volume finito
das moléculas.
Em relação às equações de estado aplicadas aos gases, julgue o item.
A equação de van der Waals é uma correção à equação
dos gases ideais.
I. Trocar o material que constituiu a parede por outro com maior condutividade térmica.
II. Reduzir a área superficial do forno.
III. Reduzir a temperatura externa da fornalha.
IV. Aumentar a espessura da parede.
Estão CORRETOS:
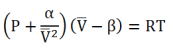
Nela, van der Waals tentou aperfeiçoar a equação de estado ideal. Com base nessas informações, analisar os itens abaixo:
I. Para cada substância, α e β são constantes determinadas no ponto crítico.
II. O termo
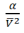 representa as forças intermoleculares.
representa as forças intermoleculares. III. β representa o volume ocupado pelas moléculas de gás.
Está(ão) CORRETO(S):
(_) A energia interna é distinta das energias potencial e cinética de um sistema, que são formas externas de energia.
(_) Nas aplicações da primeira lei da termodinâmica, todas as formas de energia devem ser consideradas, menos a energia interna.
(_) Para um sistema isolado, a primeira lei requer que sua energia varie.
(_) Para um sistema fechado (mas não isolado), a primeira lei requer que as variações de energia do sistema sejam exatamente compensadas por variações de energia do exterior.
• Coeficiente de expansão térmica do óleo diesel = 9,50x10-4/C° • Coeficiente de expansão linear do tanque = 11x10-6/C°
Na reação química 2 A + 3 B → C + 4 D ocorre a uma temperatura constante de 298 K. A entalpia de formação padrão de A, B, C e D é, respectivamente, 200, 300, 500 e 100 kJ/mol. Qual é a variação de entalpia (ΔH) da reação?
(Considerações: 1. perda de calor para a vizinhança desprezível; 2. resistência térmica da parede do tubo desprezível; 3. propriedades constantes; 4. negligenciar mudanças de energias cinética e potencial.)
(Considerações: 1. meio com propriedades constantes; 2. condução térmica unidimensional; 3. não há geração de calor na parede; 4. estado estacionário; 5. supor que as temperaturas das superfícies da parede sejam as temperaturas externas e internas dadas.)
Dados: Massa molecular da fosfina igual a 34,0 g∙mol-1 ; R = 0,082 L∙atm∙K-1 ∙mol-1 .
Analise o texto abaixo:
Apesar da sua toxicidade, a amônia é um fluido refrigerante de ampla utilização em sistemas de refrigeração pois possui excelentes propriedades .........(1)......... , pode-se trabalhar com pressões .........(2)......... de modo que materiais leves podem ser utilizados na construção do equipamento de refrigeração, tem .........(3)......... custo e apresenta odor característico facilitando a identificação de vazamentos.
Assinale a alternativa que completa corretamente as lacunas numeradas do texto.