Questões de Concurso
Sobre termodinâmica e equilíbrio de fases em engenharia química e química industrial
Foram encontradas 511 questões
Dados: ρ = 103 kg/m3 g= 10 m/s2 . Área dos tubos uniforme 5,0 cm2 .
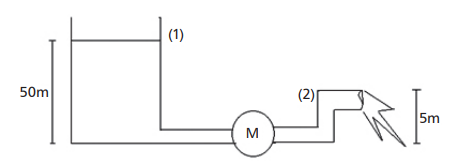
FIGURA . BRUNETTI, F. Mecânica dos Fluidos, 2008, p. 94 a 95 (Adaptada).
A potência da turbina é
Analise as afirmativas abaixo e marque (V) para Verdadeiro ou (F) para Falso:
( ) Bombas são equipamentos que recebem trabalho e o convertem em energia mecânica.
( ) Turbinas são equipamentos que recebem o trabalho e o convertem em energia mecânica.
( ) Turbinas são equipamentos que recebem energia e convertem em trabalho mecânico.
( ) Vasos de pressão são equipamentos utilizados para armazenamento e aquecimento de fluidos e podem possuir formato vertical ou horizontal.
( ) Caldeiras são equipamentos utilizados para armazenamento e aquecimento de fluidos e podem possuir formato vertical ou horizontal.
A sequência correta é:
I. Fluidos homogêneos são normalmente divididos em duas classes: líquidos e gases. II. A distinção entre as fases líquido e gás nem sempre pode ser delimitada com nitidez, porque as duas fases tornam-se indistinguíveis no chamado ponto crítico. III. Por meio do diagrama pressão/temperatura (PT), é possível construir as curvas de sublimação, vaporização e fusão. O ponto onde as três curvas se encontram no diagrama é chamado de ponto triplo e é onde as três fases se encontram em equilíbrio.
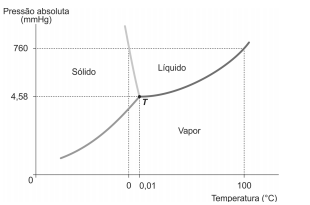
I. O congelamento deve-se dar abaixo do ponto triplo. II. A sublimação da água presente no alimento deve-se dar em pressão menor que 4,58 mmHg. III. É mais vantajoso primeiro sublimar a água e depois congelar. IV. Na liofilização, é necessário primeiro congelar o alimento para depois sublimar a água do mesmo.
Está correto o que se afirma APENAS em