Questões de Concurso
Sobre termodinâmica e equilíbrio de fases em engenharia química e química industrial
Foram encontradas 557 questões
As equações para a pressão de vapor do NaF sólido e líquido com a pressão são, respectivamente, as seguintes:
Inp =
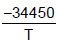 - 2,01lnT + 33,740 Inp =
- 2,01lnT + 33,740 Inp = 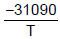 - 2,52lnT + 34,660
- 2,52lnT + 34,660 O calor de fusão, ∆H, do fluoreto de sódio (NaF), no ponto triplo, em KJ, é
Dado pressão na equação em (atm), temperatura na equação em (K) e constante dos gases R = 8,3144 JK-1 mol-1
A eficiência dessa máquina térmica é de
A relação de Maxwell correspondente é
Dado Expansão volumétrica = α = 5,0 x 10-5 K-1 Volume específico = v = 0,000114 m3/Kg
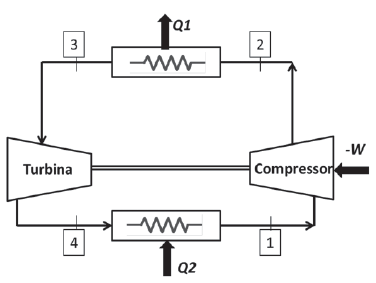
Considere o ciclo-padrão a ar de refrigeração simples, onde o ar entra no compressor a 0,1 MPa e 253 K, deixando-o a 0,5 MPa. O modelo utilizado para o ar é de gás perfeito com Cp = 1,0035 KJ Kg-1 K-1, Cv = 0,7165 KJ Kg-1 K-1 para uma temperatura de 300K.
Cada processo ocorre em regime permanente e não ocorrem variações de energia cinética ou potencial no sistema.
Sabendo-se que o ar entra na turbina a 288 K, o coeficiente de eficácia desse ciclo é de
Qual o trabalho realizado, em KJ?
A energia de Gibbs nessas condições, em KJmol-1, é
Dado Pressões parciais, em bar, do SO2(g), O2(g), SO3(g), respectivamente, 10-3, 0,20, 10-4. Constante dos gases, R = 8,314 J.-1 .mol-1; Logaritmo Neperiano, ln(5)=1,609; ln(10)=2,303.
Considerando-se a idealidade, a composição da fase vapor em equilíbrio com a solução é
O trabalho de compressão em KJ por Kg de ar comprimido é
Dado a T=290 K, volume específico = 0,826 m3/Kg

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 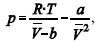 julgue o item que segue.
julgue o item que segue.
A partir do gráfico apresentado, conclui-se que o CO2 (g)
apresenta a constante b na equação de van der Waals inferior
à do O2 (g).

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 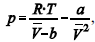 julgue o item que segue.
julgue o item que segue.
Quando atingida a pressão de 300 atm e a temperatura T2, o
volume ocupado pelo gás será menor do que aquele que seria
ocupado, nas mesmas condições, por um gás ideal.

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 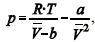 julgue o item que segue.
julgue o item que segue.
A uma pressão de 1,00 atm e temperatura de 300 K, o volume
ocupado pelo O2 (g) formado na decomposição de 4,00 mol de
H2O2 será superior a 46,0 L.
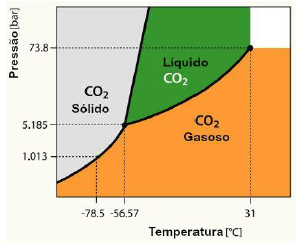
Observe o gráfico que demonstra a região de duas fases e a continuidade dos estados.
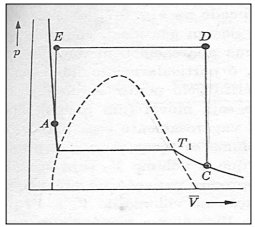
De acordo com a figura anterior, analise as afirmativas a seguir.
I. Os pontos A e C pertencem à mesma isoterma.
II. O ponto C representa um estado gasoso e o ponto A um sólido obtido comprimindo-se o gás isotermicamente.
III. A reta EA mostra quando o volume é mantido constante e o gás é resfriado, diminuindo a pressão.
IV. Em nenhum instante dessa série de mudanças o ponto que representa o estado do gás passou através da região de duas fases.
Estão corretas as afirmativas
Afirma-se que ΔG é o critério básico de espontaneidade. Uma reação ocorre espontaneamente se ΔG tem valor negativo. Lembrando que por tratamento termodinâmico, a fórmula da variação da energia livre padrão é definida por: ΔGo = – RT ln K. Se substituirmos R por 8,31 x 10–3 (quilojoules por Kelvin) e ln K por 2,30 log10 K, tem-se a seguinte fórmula descrita:
ΔGo (em quilojoules) = –2,30(8,31 x 10–3 )T log10K = –0,0191T log10K
Assinale a alternativa que NÃO contempla a energia livre padrão em sua fórmula substituída:
Sendo (pf ,Tf ), respectivamente, a pressão e a temperatura ao fim do processo acima, podem ser escritas essas duas grandezas, em função de (p0 ,T0 ), como: