Questões de Concurso
Sobre termodinâmica e equilíbrio de fases em engenharia química e química industrial
Foram encontradas 513 questões

Face ao exposto, assinale a alternativa correta.
“Quando alguma condição que determina o equilíbrio é modificada, o sistema responde, no sentido de amenizar a perturbação sofrida”.
O texto corresponde ao(à):
A reação de síntese da amônia em fase gasosa
3H2(g) + N2(g) → 2NH3(g)
é acompanhada por variações de entalpia e de entropia do sistema.
As variações de entalpia (kJ) e entropia (J.K-1) em função da temperatura são apresentadas nas figuras a seguir.
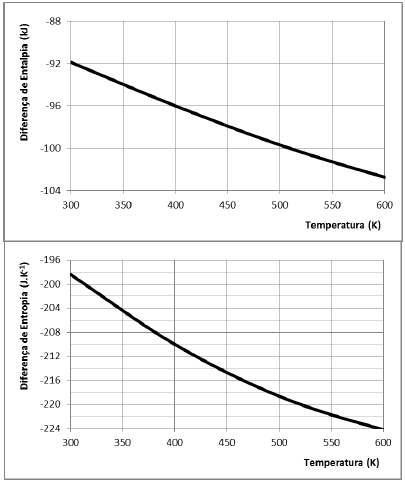
Utilizando os dados apresentados, o valor da energia livre de
Gibbs, em kJ, a 400 K é de
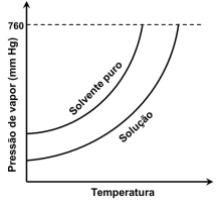
A partir do gráfico, é CORRETO afirmar:
A Figura abaixo mostra um diagrama de fases de uma substância pura.
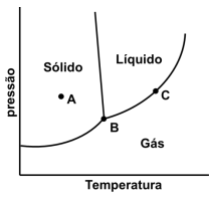
O número de fases que estão presentes em cada um dos pontos circulares identificados como A, B e C,
respectivamente, nessa figura, é
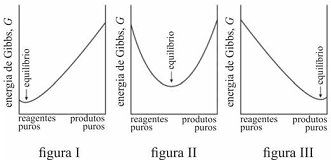
É possível prever, termodinamicamente, se os reagentes de uma mistura têm a tendência espontânea para se transformarem em produtos, se a composição, no equilíbrio, será modificada ao se alterarem as condições de um sistema, entre outros comportamentos termodinâmicos. Acerca de equilíbrio químico e considerando os gráficos representados nas figuras I, II e III, que mostram três situações de equilíbrio, julgue o item que se segue.
Na reação representada pelo gráfico da figura I, quantidades muito pequenas dos reagentes se convertem em produtos antes que G alcance seu valor mínimo e a reação se processe lentamente.
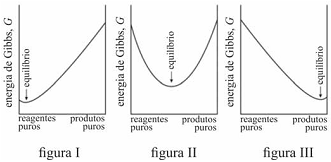
É possível prever, termodinamicamente, se os reagentes de uma mistura têm a tendência espontânea para se transformarem em produtos, se a composição, no equilíbrio, será modificada ao se alterarem as condições de um sistema, entre outros comportamentos termodinâmicos. Acerca de equilíbrio químico e considerando os gráficos representados nas figuras I, II e III, que mostram três situações de equilíbrio, julgue o item que se segue.
O critério termodinâmico para uma transformação espontânea, à temperatura e à pressão constantes, é que a variação da energia de Gibbs seja maior que zero.
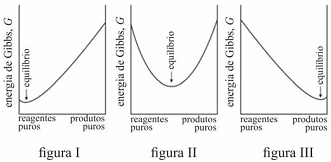
É possível prever, termodinamicamente, se os reagentes de uma mistura têm a tendência espontânea para se transformarem em produtos, se a composição, no equilíbrio, será modificada ao se alterarem as condições de um sistema, entre outros comportamentos termodinâmicos. Acerca de equilíbrio químico e considerando os gráficos representados nas figuras I, II e III, que mostram três situações de equilíbrio, julgue o item que se segue.
Em uma reação química, a variação da energia de Gibbs de
reação com a temperatura depende da entropia de reação. A
energia de Gibbs de uma reação que produz gás aumenta com
o aumento da temperatura.
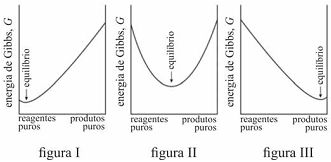
Caso G varie como apresentado no gráfico da figura III, uma
proporção alta de produtos tende a se formar antes de G
alcançar seu mínimo.
Com relação à energia interna e à primeira lei da termodinâmica, julgue o item a seguir.
Considere que um gás ideal, ocupando um volume de 2,0 L,
tenha sofrido uma transformação isobárica, a uma pressão de
1,5 atm, e tenha passado a ocupar um volume de 4,5 L,
absorvendo, nesse processo, 1.000 J de calor. Nessa situação,
a variação da energia interna do sistema é superior a 615 J.