Questões de Engenharia Química e Química Industrial - Termodinâmica e Equilíbrio de Fases para Concurso
Foram encontradas 492 questões
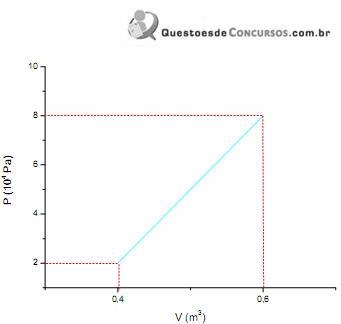
Sabendo que 20 mols de um gás perfeito sofreu uma determinada variação indicada pelo diagrama de trabalho anterior, é correto afirmar que a quantidade de calor recebida pelo sistema foi de, aproximadamente,
(Considere: R = 8,31 J/mol . K.)
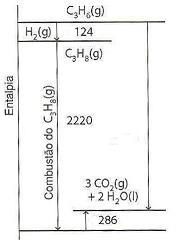
De acordo com as informações anteriores, qual é a entalpia padrão de combustão do propeno?
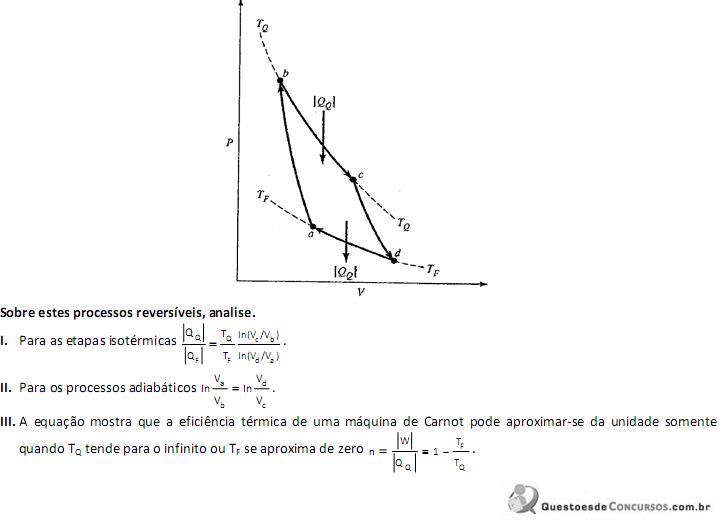
Está(ão) correta(s) a(s) afirmativa(s)
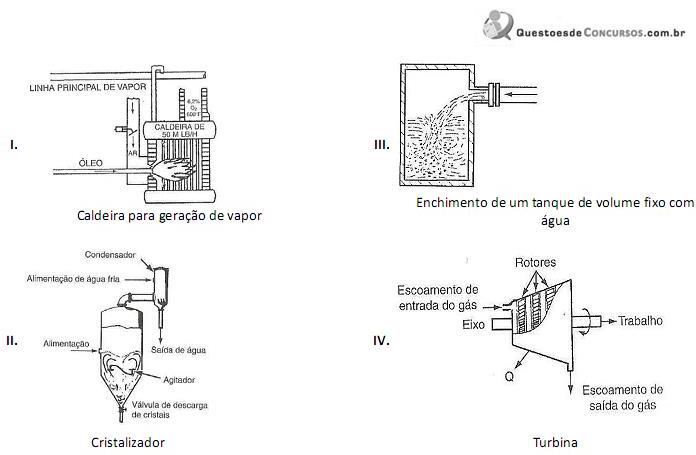
Estão corretos apenas os processos
A imagem a seguir representa um diagrama Txy à pressão constante para um sistema binário exibindo o equilíbrio íquido / líquido / vapor (ELLV).
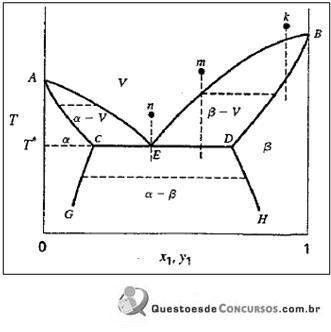
De acordo com as informações, marque V para as afirmativas verdadeiras e F para as falsas.
( ) Os pontos C e D representam as duas fases líquidas e o ponto E representa a fase vapor.
( ) Na temperatura acima T*, o sistema pode ser uma única fase líquida, duas fases
(líquida e vapor) ou uma única fase vapor dependendo da composição global.
( ) As composições das fases em equilíbrio e, consequentemente, a localização
das linhas não variam com a pressão.
( ) A região identificada por V existe fases líquidas e vapor em equilíbrio.
A sequência está correta em
Um tanque rígido, termicamente isolado, está conectado a duas tubulações, ambas equipadas com válvulas. Uma dessas tubulações é uma linha com vapor d’ água a 1000 kPa e 600 K. A outra é uma linha conectada a uma bomba de vácuo. As duas válvulas estão inicialmente fechadas. A válvula para a bomba de vácuo é então aberta lentamente, de modo a evacuar o tanque por completo. Essa válvula é então fechada. A seguir, abre‐se lentamente a válvula da linha de vapor permitindo a entrada cuidadosa de vapor para o tanque evacuado, até que a pressão deste esteja equalizada à pressão da linha de vapor.
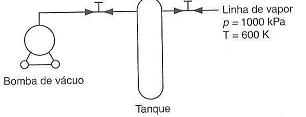
Para o processo descrito, marque V para as afirmativas verdadeiras e F para as falsas.
( ) O tanque é um sistema aberto estacionário.
( ) O balanço geral de energia pode ser representado pela equação UT2 - 0= - ( Hsai – Hentra).
( ) Há transferência de calor no processo.
( ) Inicialmente, não há massa no sistema, de modo que UT1 = 0.
A sequência está correta em
Um dos fatores que deve ser considerado na classificação de um material como alto explosivo é a velocidade da onda explosiva ou onda de choque.
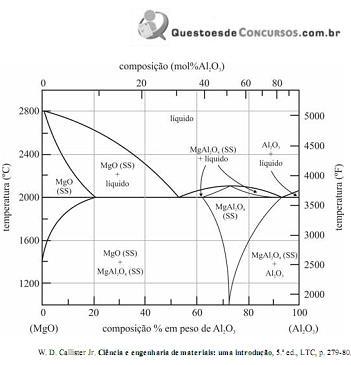
Considerando o diagrama de fases para o sistema óxido de magnésio-óxido de alumina mostrado na figura acima, em que SS corresponde a solução sólida, julgue o item a seguir.
Na região do diagrama rica em MgO, observa-se alta solubilidade de Al2O3 em MgO, independentemente da temperatura.

Considerando o diagrama de fases para o sistema óxido de magnésio-óxido de alumina mostrado na figura acima, em que SS corresponde a solução sólida, julgue o item a seguir.
A partir do diagrama é possível inferir que, para determinadas temperaturas e proporções de Al2O3 e MgO, será formada uma fase intermediária estável com estrutura de espinélio.

Considerando o diagrama de fases para o sistema óxido de magnésio-óxido de alumina mostrado na figura acima, em que SS corresponde a solução sólida, julgue o item a seguir.
Se uma amostra tiver composição nominal, em peso, igual a 20% de Al2O3 e 80% de MgO, então quando ela for aquecida até 2.400 °C, apresentará fração mássica de MgO igual a 30%, enquanto a de líquido será igual a 70%.

Considerando o diagrama de fases para o sistema óxido de magnésio-óxido de alumina mostrado na figura acima, em que SS corresponde a solução sólida, julgue o item a seguir.
Uma amostra cuja composição nominal, em peso, seja de 20% de Al2O3 e 80% de MgO e que tenha sido aquecida a até 2.400 ºC, apresentará uma fase líquida com aproximadamente 15% em peso de Al2O3 em sua composição.
Em determinadas condições, é possível que 100 g de água estejam contidos em 1,0 kg de ar úmido a 25 °C.
Se a temperatura de bulbo úmido e a de bulbo seco forem iguais, então o ar estará saturado, não sendo necessária a carta psicrométrica para estimar a umidade relativa.
Em uma carta psicrométrica, as linhas de umidade relativa constante se afastam à medida que a temperatura de bulbo seco aumenta.
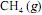 em função da pressão para duas temperaturas distintas (T1 eT2 ) e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue o item que se segue.
em função da pressão para duas temperaturas distintas (T1 eT2 ) e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue o item que se segue.Na temperatura e pressão correspondentes ao ponto A da figura II, o potencial químico do metano gasoso é superior ao do metano líquido.
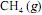 em função da pressão para duas temperaturas distintas (T1 eT2 ) e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue o item que se segue.
em função da pressão para duas temperaturas distintas (T1 eT2 ) e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue o item que se segue.O CH4 não pode ser liquefeito por simples compressão à temperatura de 150 K, uma vez que o ponto B, na figura II, corresponde à temperatura crítica desse gás.
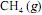 em função da pressão para duas temperaturas distintas (T1 eT2 ) e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue o item que se segue.
em função da pressão para duas temperaturas distintas (T1 eT2 ) e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue o item que se segue.Infere-se da situação mostrada na figura I que T1 é maior que T2.
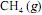 em função da pressão para duas temperaturas distintas (T1 eT2 ) e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue o item que se segue.
em função da pressão para duas temperaturas distintas (T1 eT2 ) e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue o item que se segue.Na temperatura
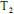 , o
, o 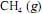 , a 200 bar de pressão, ocupará um volume superior ao estimado pela equação dos gases ideais, o que demonstra que as forças atrativas predominam sobre as forças repulsivas.
, a 200 bar de pressão, ocupará um volume superior ao estimado pela equação dos gases ideais, o que demonstra que as forças atrativas predominam sobre as forças repulsivas.  , cuja equação de combustão é
, cuja equação de combustão é . A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
. A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
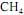 ocorra de forma completa; que a entalpia padrão de combustão do
ocorra de forma completa; que a entalpia padrão de combustão do 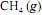 , a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
, a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.Considerando-se um comportamento ideal para a mistura sob pressão total p, é correto afirmar que, em uma amostra de gás natural constituída por 95%, em massa, de metano e, o restante, de etano, a pressão parcial do metano será superior a 0,95p.
