Questões de Concurso
Sobre termodinâmica e equilíbrio de fases em engenharia química e química industrial
Foram encontradas 557 questões
Ayahuasca é uma bebida produzida a partir de duas plantas amazônicas, Banisteriopsis caapi e Psychotria viridis, utilizada em rituais religiosos. Nessa bebida podem ser encontradas as substâncias harmina, harmalina e tetraidroarmina, as quais atuam no sistema nervoso central. Com base nessa informação e nas estruturas químicas mostradas acima, julgue os itens a seguir.
O átomo de carbono da ligação C=O da N-acetil-6-metoxitriptamina apresenta hibridização sp2 de acordo com a teoria da ligação de valência.
Em uma reação de oxirredução com potencial padrão de reação positivo e com diminuição na energia livre de Gibbs, é observado um processo espontâneo.

No ciclo de Carnot, ilustrado acima, no gráfico de pressão (P)
versus volume (V), ocorrem processos reversíveis que passam pelos
estados A, B, C e D. Considerando que as curvas do gráfico
apresentam o comportamento de um gás ideal em um sistema
fechado, que os processos BC e DA são adiabáticos e que AB e CD
são isotérmicos, ocorrendo nas temperaturas T2 e T1,
respectivamente, julgue o item.

No ciclo de Carnot, ilustrado acima, no gráfico de pressão (P)
versus volume (V), ocorrem processos reversíveis que passam pelos
estados A, B, C e D. Considerando que as curvas do gráfico
apresentam o comportamento de um gás ideal em um sistema
fechado, que os processos BC e DA são adiabáticos e que AB e CD
são isotérmicos, ocorrendo nas temperaturas T2 e T1,
respectivamente, julgue o item.

No ciclo de Carnot, ilustrado acima, no gráfico de pressão (P)
versus volume (V), ocorrem processos reversíveis que passam pelos
estados A, B, C e D. Considerando que as curvas do gráfico
apresentam o comportamento de um gás ideal em um sistema
fechado, que os processos BC e DA são adiabáticos e que AB e CD
são isotérmicos, ocorrendo nas temperaturas T2 e T1,
respectivamente, julgue o item.

No ciclo de Carnot, ilustrado acima, no gráfico de pressão (P)
versus volume (V), ocorrem processos reversíveis que passam pelos
estados A, B, C e D. Considerando que as curvas do gráfico
apresentam o comportamento de um gás ideal em um sistema
fechado, que os processos BC e DA são adiabáticos e que AB e CD
são isotérmicos, ocorrendo nas temperaturas T2 e T1,
respectivamente, julgue o item.
O calor transferido durante o processo AB pode ser
determinado pela expressão 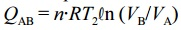 em que n é
quantidade de matéria, VA e VB os volumes do gás nos pontos
A e B, respectivamente, e R a constante universal dos gases.
em que n é
quantidade de matéria, VA e VB os volumes do gás nos pontos
A e B, respectivamente, e R a constante universal dos gases.
Adote: constante universal de gás R = 8,3 kJ.K–1 .mol–1 ; 0 ºC igual a 273 ºK
No ciclo de Carnot, ilustrado acima, no gráfico de pressão (P) versus volume (V), ocorrem processos reversíveis que passam pelos estados A, B, C e D. Considerando que as curvas do gráfico apresentam o comportamento de um gás ideal em um sistema fechado, que os processos BC e DA são adiabáticos e que AB e CD são isotérmicos, ocorrendo nas temperaturas T2 e T1, respectivamente, julgue o item subsequente.
Nas condições especificadas, se T1 for menor do que T2, o
rendimento desse ciclo será de 100%.
No ciclo de Carnot, ilustrado acima, no gráfico de pressão (P) versus volume (V), ocorrem processos reversíveis que passam pelos estados A, B, C e D. Considerando que as curvas do gráfico apresentam o comportamento de um gás ideal em um sistema fechado, que os processos BC e DA são adiabáticos e que AB e CD são isotérmicos, ocorrendo nas temperaturas T2 e T1, respectivamente, julgue o item subsequente.
O trabalho e o calor não são funções de estado, diferentemente
da energia interna, que depende somente do estado em que se
encontra o sistema.
No ciclo de Carnot, ilustrado acima, no gráfico de pressão (P) versus volume (V), ocorrem processos reversíveis que passam pelos estados A, B, C e D. Considerando que as curvas do gráfico apresentam o comportamento de um gás ideal em um sistema fechado, que os processos BC e DA são adiabáticos e que AB e CD são isotérmicos, ocorrendo nas temperaturas T2 e T1, respectivamente, julgue o item subsequente.
A variação da entropia para o sistema e suas vizinhanças, após
o gás percorrer o ciclo acima e retornar ao estado inicial A, é
nula.
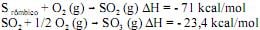
Considerando essas equações químicas, julgue os itens seguintes.
Para um processo que ocorre sob temperatura constante, a energia livre de Gibbs pode ser calculada por ΔG = ΔH - T ΔS.
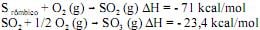
Considerando essas equações químicas, julgue os itens seguintes.
A entropia da reação global aumentou porque seu ΔH é mais negativo que os ΔH das etapas da reação.
subsequentes.
subsequentes.
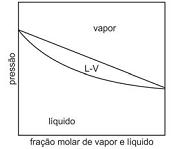
os seguintes itens.
