Questões de Concurso
Sobre termodinâmica e equilíbrio de fases em engenharia química e química industrial
Foram encontradas 557 questões
I - A transformação martensítica é uma transformação anisotérmica que ocorre abaixo de uma temperatura crítica.
II - Durante a transformação martensítica, a concentração de carbono da ferrita não muda.
III - Durante a transformação martensítica, a concentração de carbono da austenita não muda.
IV - A transformação martensítica ocorre sem difusão de longo alcance.
Está correto APENAS o que se afirma em
A forma da curva C de uma curva TTT ocorre porque, em temperaturas muito baixas, a força motriz para a transformação é muito
Sendo assim, conclui-se que o(s) aço(s)
Que microestrutura será observada no microscópio óptico após preparação metalográfica?
Essas fases sofrem diversas transformações em função da temperatura, sabendo-se que, durante o
Cp = 33,25 + 0,033. T
onde T está em ºC.
Modificando a equação de modo que forneça o Cp na unidade cal . mol -1. K-1 , obtém-se
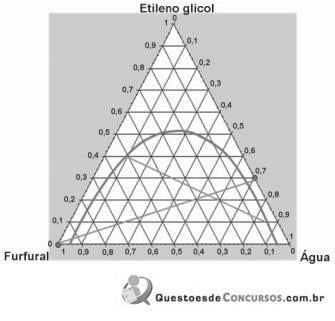
A figura apresenta um diagrama para extração de uma mistura de etileno glicol e água por furfural. A corrente de alimentação é de 1.520 kg/h, e é adicionado contracorrente o solvente.
Quantos quilogramas de solvente são necessários e suficientes para conseguir efetuar essa extração?
Numa mistura em temperatura constante, o ponto de bolha
O equilíbrio de fase
Se a potência líquida entregue ao refrigerador é de 2,0 kW, qual o coeficiente de performance desse refrigerador?
A derivada parcial
 da entropia específica do gás em relação à pressão, a uma temperatura constante, é dada pela expressão
da entropia específica do gás em relação à pressão, a uma temperatura constante, é dada pela expressão 
onde a, b e R são constantes, p é a pressão, T a temperatura absoluta, e v o volume molar do gás.

onde a, b e R são constantes, p é a pressão, T a temperatura absoluta, e v o volume molar do gás.
O diagrama T versus p dessa transformação é uma reta, cuja inclinação é
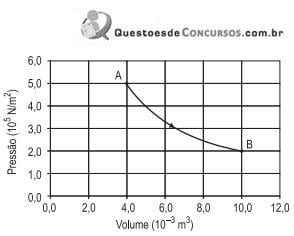
Qual é, aproximadamente, a quantidade de calor em J trocada entre o sistema e a vizinhança durante essa transformação?
Dado: ln 2,5 = 0,9
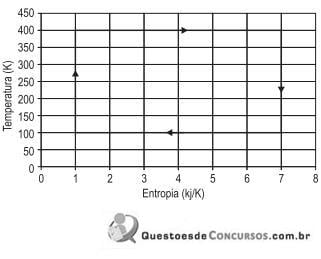
Qual a eficiência desse ciclo?
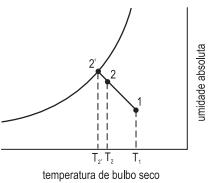
No diagrama, é mostrado um processo de psicrometria onde uma corrente de ar é passada por uma névoa de água, sendo que esse ar passa de uma condição 1 para uma condição 2. A temperatura do ar na condição 1 é 50 oC, a temperatura na condição 2 é de 35 oC, e a temperatura da água usada no processo é de 25 oC.
Qual é a eficiência de saturação nesse processo?
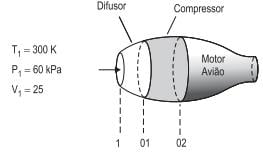
A figura representa uma turbina de avião. Numa turbina de avião, o ar sofre compressão antes da entrada do motor. O ar que entra no difusor tem temperatura T1 = 300 K, pressão P1 = 60 kPa, velocidade V1 = 250 m/s, e a cp do ar é 1,00 kJ/(kg.K).
Se o processo é esentrópico, qual é a temperatura da entrada do compressor (T01 )?
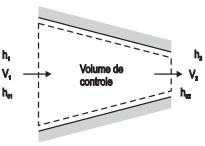
Na figura, pode ser visto um processo de estrangulamento adiabático de um fluxo de gás, sendo que h1 e h2 são as entalpias do gás, V1 e V2 são as velocidades do gás, e h01 e h02 são as entalpias de estado estacionário.
Se o diâmetro de entrada é duas vezes maior que a saída e a entalpia do gás não se altera (h1 = h2 ), então