Questões de Concurso
Sobre termodinâmica e equilíbrio de fases em engenharia química e química industrial
Foram encontradas 557 questões
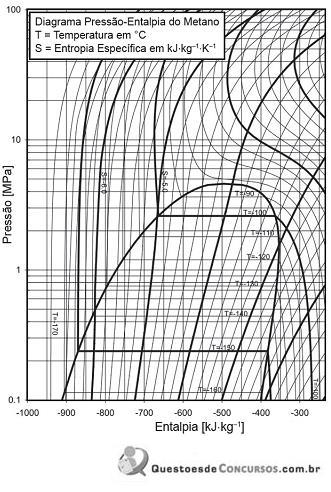
Metano líquido saturado a uma pressão de 0,7 MPa passa por uma expansão isotérmica até uma pressão de 0,2 MPa.
De acordo com o diagrama acima, a variação de entalpia nesse processo (em kJ/kg) é, aproximadamente, de
Neste contexto, a(s)
Assim, usando a relação de Maxwell correspondente, a variação de entropia (dS) T do sistema no referido processo é igual a
(hi representa a entalpia molar do composto i)
hCO(370 o C) - hCO(300 o C) = 2,2 x 103 J/mol
hH2O(370 o C) - hH2O(300 o C) = 2,6 x 103 J/mol
calor de reação a 370 o C ≈ -4 x 104 J/mol
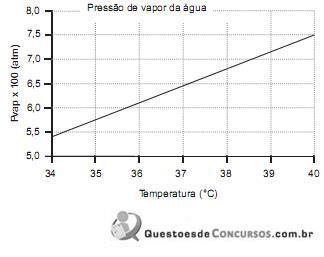
De acordo com o gráfico acima, a temperatura, em graus Celsius, de uma corrente de ar na pressão atmosférica com umidade relativa de 40% e 3% de água em base volumétrica é de, aproximadamente,
Dados
Massa molar da água = 18 g/mol
Massa molar do ar = 29 g/mol
Constante dos gases = 8,314 J/mol/K
“A maior parte [da água da Terra] veio dos asteroides que deram uma contribuição de mais de 50%. Uma pequena parcela veio da nebulosa solar, com 20% de participação e os 30% restantes, dos cometas.”
(Fonte: http://www.inovacaotecnologica.com.br/noticias/noticia.php?artigo=origem-da-agua-da-terra#.VAOaaPldVqU. Acessado em 31/08/2014.)
Considerando-se a reação de formação da água líquida a partir de seus elementos, ocorrendo a 25ºC, em condições de temperatura e pressão constantes, e os valores termodinâmicos apresentados a seguir, assinale a alternativa CORRETA.
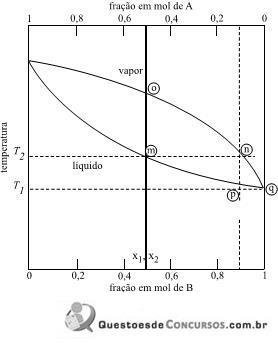
Nesse diagrama, entre os pontos indicados, o que corresponde à temperatura de início da ebulição da mistura equimolar é o ponto
Dos processos do ciclo Otto, o que provoca o maior aumento da pressão é a
Na nitretação líquida, a espessura da camada nitretada
No que concerne às centrais de vapor central utilizadas em indústrias de alimentos, julgue os itens a seguir.
Em uma indústria que processa cerca de 10 toneladas de alimento por dia, com teor de água médio de 30%, as caldeiras aquatubulares supercríticas são as mais indicadas para produzir o vapor de processo.
Acerca dos processos de concentração de alimentos por evaporação e dos equipamentos relacionados a esses processos, julgue os itens a seguir.
A temperatura de ebulição do líquido tratado em um evaporador diminui conforme a profundidade.
entalpias padrão de combustão:
benzeno (C6H6 (l)): – 3268 KJ
ciclohexano (C6H12 (l)): – 3902 kJ
entropias molares padrão : :
H2O (l): 75 J K-1 mol-1
H2 (g): 131 J K-1 mol-1
O2 (g): 205 J K-1 mol-1
Reações:
(I) H2 (g) + ½ O2 (g) → H2O (l) (entalpia padrão de reação = - 286 kJ)
(II) C6H6 (l) + 3 H2 (g) → C6H12 (l)
Considerando as informações acima, julgue os itens subsequentes, relacionados a conceitos de termoquímica.
A partir dos valores de entropias molares padrão , a entropia padrão para a reação I é de -327 J K-1 mol-1.
entalpias padrão de combustão:
benzeno (C6H6 (l)): – 3268 KJ
ciclohexano (C6H12 (l)): – 3902 kJ
entropias molares padrão : :
H2O (l): 75 J K-1 mol-1
H2 (g): 131 J K-1 mol-1
O2 (g): 205 J K-1 mol-1
Reações:
(I) H2 (g) + ½ O2 (g) → H2O (l) (entalpia padrão de reação = - 286 kJ)
(II) C6H6 (l) + 3 H2 (g) → C6H12 (l)
Considerando as informações acima, julgue os itens subsequentes, relacionados a conceitos de termoquímica.
Para um processo reversível, a variação da entropia é maior ao se reduzir a temperatura.
Figura I
Figura II
As figuras acima mostram os ajustes lineares dos dados experimentais da variação da concentração de [A] em função do tempo t.
Sendo 𝓁n (2,718) = 1,0 e 𝓁n (1,07) = 0,069, julgue os itens subsequentes acerca dos conceitos de cinética química, considerando a reação A + B → AB e as figuras I e II acima.
O valor da constante de velocidade na equação de velocidade da reação é 2,66 x 10-2.
Figura I
Figura II
As figuras acima mostram os ajustes lineares dos dados experimentais da variação da concentração de [A] em função do tempo t.
Sendo 𝓁n (2,718) = 1,0 e 𝓁n (1,07) = 0,069, julgue os itens subsequentes acerca dos conceitos de cinética química, considerando a reação A + B → AB e as figuras I e II acima.
A partir dos ajustes lineares da variação da concentração de [A] em função do tempo t, a velocidade de consumo de [A] na reação geral I corresponde a uma cinética de segunda ordem.
Acerca dos modelos que se propuseram a explicar a estrutura atômica e as ligações químicas, julgue os itens subsequentes.
De acordo com a teoria do orbital molecular, um orbital σC-O é mais estável que um orbital πC-O.
O processo de biossíntese do colesterol inicia-se na reação entre dimetilalilpirofosfato (DMAPP) e isopentenilpirofosfato (IPP). O produto dessa reação é o geranilpirofosfato (GPP) que, além de conduzir à síntese de colesterol, por meio da formação de esqualeno, também origina a vasta classe dos terpenos. Com relação às reações envolvidas na síntese do colesterol e às estruturas químicas dos compostos relacionados descritas na figura acima, julgue os itens a seguir.
A ligação C-O de IPP é mais polarizada que a ligação C-O de DMAPP.
