Questões de Concurso
Sobre termodinâmica e equilíbrio de fases em engenharia química e química industrial
Foram encontradas 511 questões
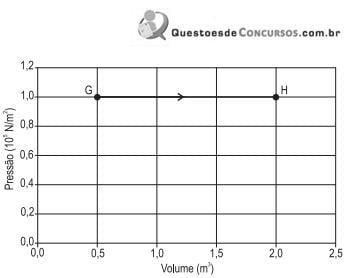
Se a energia interna do gás, após a transformação, aumentou em 2,4 x 105 J, qual a quantidade de calor trocada entre o gás e a vizinhança?
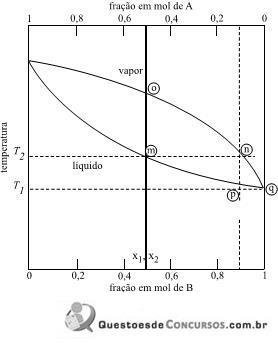
Nesse diagrama, entre os pontos indicados, o que corresponde à temperatura de início da ebulição da mistura equimolar é o ponto
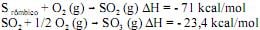
Considerando essas equações químicas, julgue os itens seguintes.
Para um processo que ocorre sob temperatura constante, a energia livre de Gibbs pode ser calculada por ΔG = ΔH - T ΔS.
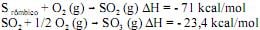
Considerando essas equações químicas, julgue os itens seguintes.
A entropia da reação global aumentou porque seu ΔH é mais negativo que os ΔH das etapas da reação.
1- Um soluto cristaliza a partir de uma solução.
2- Água evapora.
3- AgCl sólido precipita a partir de uma solução de AgNO3 e NaCl.
Para estes 3 casos podemos afirmar:
I. Se ?G for negativo a reação a T e P constantes é espontânea.
II. Se ?G for positivo a reação a T e P constantes é não espontânea.
III. Se ?G for igual a zero o sistema está em equilíbrio. IV. Se ?G for positivo a reação a T e P constantes não se deslocará em nenhuma direção.
verifica-se que estão corretas
Dado: R = 2 cal.K-1 .mol-1 ; ln 10 = 2,3
Dos processos do ciclo Otto, o que provoca o maior aumento da pressão é a
subsequentes.
subsequentes.
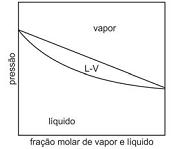
os seguintes itens.

