Questões de Concurso
Sobre termodinâmica e equilíbrio de fases em engenharia química e química industrial
Foram encontradas 513 questões
Sendo assim, na saída da válvula de estrangulamento, parcialmente aberta e isolada termicamente, o fluido encontra-se na condição de
A fração do calor fornecido pela fonte quente que é convertido em trabalho mecânico é igual a
Esse processo pode ser representado em um diagrama pressão, P, versus entalpia específica, H, através de uma linha
Um mol de um gás ideal com capacidades caloríficas
constantes (Cp
e Cv
) sofre uma expansão isentrópica de
um estado inicial a uma temperatura T1
e uma pressão
P1
a um estado final, a uma temperatura T2
e uma pressão P2
. Se a razão for igual a ϒ, então, a razão P1/P2 será igual a
Se, para esse processo, as variações de entalpia e entropia específicas forem representadas por (ΔH) e (ΔS), respectivamente, então,
respectivamente, energia interna, entropia e volume molares, e as variáveis T e P são, respectivamente, temperatura e pressão.
A relação de Maxwell obtida a partir da equação acima é
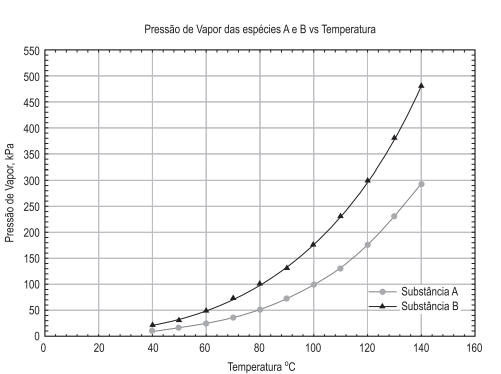
Uma mistura formada pelos componentes A e B se encontra à pressão de 120 kPa. No aquecimento dessa mistura, na pressão especificada, é formada a primeira bolha na temperatura de 100 °C. Dadas as respectivas curvas da pressão de vapor dos componentes A e B, presentes na figura acima, a composição aproximada da fase líquida e a da fase vapor em relação ao componente A, na temperatura de 100 °C, são, respectivamente,
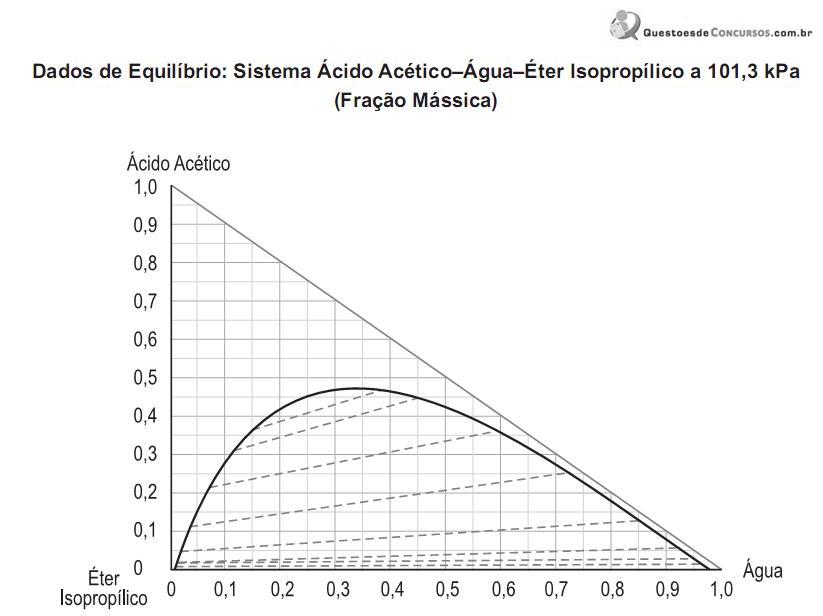
Considere que 1.000 kg/h de uma solução com 35% (massa) de ácido acético e 65% (massa) de água é alimentada a uma coluna de extração que opera em contracorrente. Para extrair o ácido acético, são usados 1.335 kg/h de éter isopropílico. É necessário que o produto rafinado contenha apenas 10% (massa) de ácido acético.
Utilizando o gráfico da figura acima, conclui-se que a composição mássica de éter isopropílico da corrente extrato é, aproximadamente,
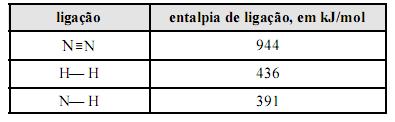
Uma forma de diminuir a pressão de vapor de amônia é
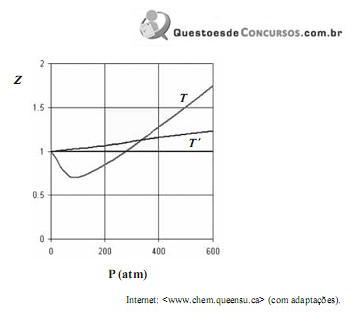
Considerando que, sob pressões elevadas, os gases deixam de apresentar comportamento ideal, e que a figura acima apresenta as curvas do coeficiente de compressibilidade (Z) para o
 em duas temperaturas distintas (T e T’), julgue os itens subsequentes.
em duas temperaturas distintas (T e T’), julgue os itens subsequentes.A temperatura T é superior à temperatura T’.


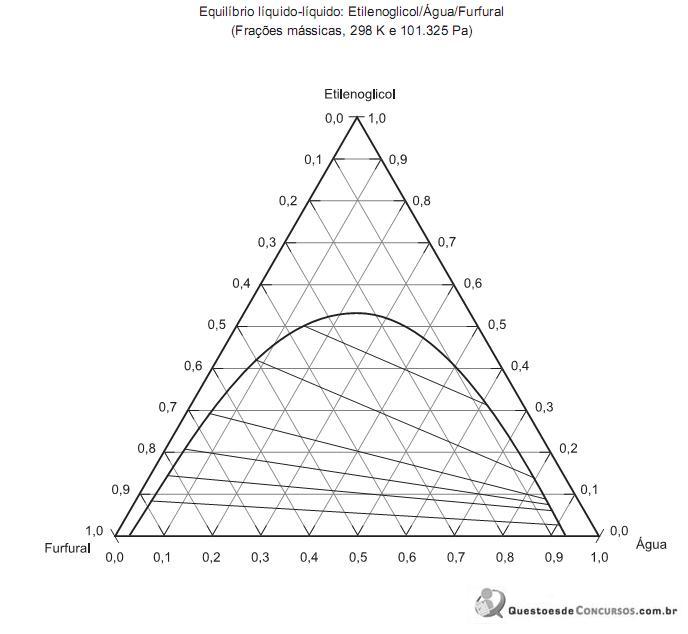
Com relação ao diagrama ternário do sistema etilenoglicol - água - furfural dado, a vazão mássica em kg/s e as composi- ções mássicas da fase extrato, são, respectivamente,
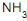 , lava-se essa mistura, em um único estágio, com água reciclada a 293 K contendo uma quantidade de amoníaco de 0,01 mol
, lava-se essa mistura, em um único estágio, com água reciclada a 293 K contendo uma quantidade de amoníaco de 0,01 mol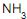 / mol
/ mol 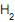 O. A composição do
O. A composição do no produto gasoso é 0,032 mol
no produto gasoso é 0,032 mol / mol ar.
/ mol ar. Dado: Curva de Equilíbrio do Sistema Amoníaco –
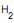 O – Ar a 293 K e 101.325 Pa.
O – Ar a 293 K e 101.325 Pa.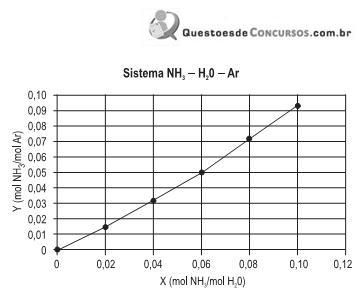
A razão entre a vazão molar do solvente e a vazão molar do ar é
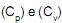 como as capacidades caloríficas molares, de um gás ideal, a pressão constante e volume constante, respectivamente, e (?) como a razão entre estas capacidades caloríficas
como as capacidades caloríficas molares, de um gás ideal, a pressão constante e volume constante, respectivamente, e (?) como a razão entre estas capacidades caloríficas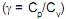 . A equação que relaciona a pressão e o volume de um gás ideal em um processo adiabático reversível, quando estas capacidades caloríficas são constantes, é dada por
. A equação que relaciona a pressão e o volume de um gás ideal em um processo adiabático reversível, quando estas capacidades caloríficas são constantes, é dada por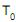 e a uma pressão
e a uma pressão 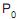 , até um estado final a uma temperatura T e a uma pressão P. Se
, até um estado final a uma temperatura T e a uma pressão P. Se 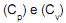 são as capacidades caloríficas molares deste gás, a pressão e volume constantes, respectivamente, e se R é a constante universal dos gases, a expressão para o cálculo da variação de entropia (?S) desse processo é
são as capacidades caloríficas molares deste gás, a pressão e volume constantes, respectivamente, e se R é a constante universal dos gases, a expressão para o cálculo da variação de entropia (?S) desse processo é• um reservatório quente (fonte quente), onde o fluído absorve uma quantidade de calor
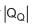 ;
; • um reservatório frio (fonte fria), onde o fluido descarta uma quantidade de calor
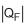 .
. Se a quantidade de trabalho líquido produzida por esse fluído for igual a
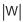 , então a eficiência térmica
, então a eficiência térmica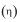 dessa máquina é dada por
dessa máquina é dada por