Questões de Concurso
Sobre termodinâmica e equilíbrio de fases em engenharia química e química industrial
Foram encontradas 557 questões
Na temperatura T, a energia livre padrão da reação apresentada é negativa, e o valor de seu módulo é superior a 5RT.
Se 10,0 mol de BrCR(g) forem colocados em uma câmara inicialmente evacuada, quando o equilíbrio químico for atingido, à temperatura T, a quantidade de matéria de Br2 será inferior a 6,0 mol.
Considerando que a reação seja endotérmica em toda a faixa compreendida entre as temperaturas T e T’ e que T’ seja maior que T, é correto concluir que a constante de equilíbrio da reação na temperatura T’ é superior a 400.
Para a reação em questão, o volume da câmara não influencia a velocidade com que o equilíbrio é atingido.
A área sombreada do gráfico corresponde ao trabalho realizado pelo gás durante a referida expansão.
A temperatura do gás é maior que 300 K.
Considere que, após a referida transformação, o sistema tenha retornado ao estado A. Nessa situação, qualquer que seja o caminho de retorno, o calor trocado com as vizinhanças e o trabalho realizado pelo sistema durante o ciclo (estado A → estado B → estado A) são ambos iguais a zero, pois calor e trabalho são funções de estado termodinâmicas.
A variação de entropia durante a transformação descrita é maior que 5 J/K.
Um tanque é completamente preenchido com 16,0 kg de metano puro (CH4), componente majoritário do gás natural. A equação a seguir apresenta a reação de combustão do metano, cuja entalpia-padrão, a 25 ºC, é igual a !890 kJ/mol.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (R)
Com base na informações acima e considerando que a massa molar do metano seja 16,0 g/mol, que a constante universal dos gases valha 0,08 atm.L.mol-1 K-1 e que os gases envolvidos na reação se comportem de forma ideal, julgue os itens que se seguem.
O módulo do calor de combustão padrão do metano, a volume constante e a 25 ºC, é maior que 890 kJ/mol.
Ligação Energia de ligação (kJ /mol)
C - H 414
H - O 463
C - O 339
C = O 716
O = O 497
O valor de ?H da reação entre metanal e oxigênio do ar produzindo ácido metanoico, em kJ/mol, é aproximadamente:
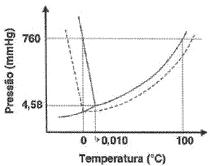
Sabendo que ele representa os diagramas de fases da água pura e de uma solução aquosa de soluto não volátil, é INCORRETO afirmar que:
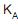 = 0,62 e
= 0,62 e 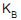 = 2,00. A fração molar do componente A, nesse vapor, é, aproximadamente,
= 2,00. A fração molar do componente A, nesse vapor, é, aproximadamente,I - Um fluido incompressível escoa sempre da menor para a maior pressão.
II - Um fluido perfeito é aquele que provoca baixas perdas de carga quando em escoamento.
III - A viscosidade de um líquido diminui com o aumento da temperatura.
IV - Manômetros diferenciais são empregados para medir a diferença de pressão estática entre dois pontos de um fluido em escoamento.
São corretas APENAS as afirmativas
A equação de estado de van der Waals, representada abaixo, é utilizada para descrever o comportamento de gases reais e inclui os parâmetros a e b.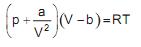
Esses parâmetros podem ser determinados empiricamente ou estimados a partir do conhecimento da temperatura e da pressão críticas do gás em questão. No caso da amônia, qual a estimativa correta para o parâmetro a, em J.m3 .mol -2 ?
Tc (NH3) = 400K
pc (NH3) = 11MPa
R = 8 J . mol-1. k-1
Um reservatório cilíndrico fechado contém dióxido de carbono a temperatura e pressão ambientes. Admitindo comportamento ideal para o gás, qual a variação estimada da entropia do 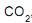 em J.mol -1 .K-1 , quando aquecido até que sua pressão atinja 270 KPa?
em J.mol -1 .K-1 , quando aquecido até que sua pressão atinja 270 KPa?
Cp (CO2) = 23 Jmol-1.K-1
R = 8 J.mol-1.K-1
Com relação ao fenômeno da volatilização, descrito acima, são feitas as afirmativas a seguir.
I - Quanto maior a pressão de vapor de uma substância, mais volátil ela será.
II - A volatilidade de uma substância só pode ser medida na mudança do estado líquido para o estado vapor.
III - A destilação usa a vaporização total das misturas líquidas para separar as substâncias mais voláteis.
IV - A temperatura na qual a pressão de vapor é igual à pressão ambiente corresponde ao ponto de ebulição de uma determinada substância.
Estão corretas APENAS as afirmativas
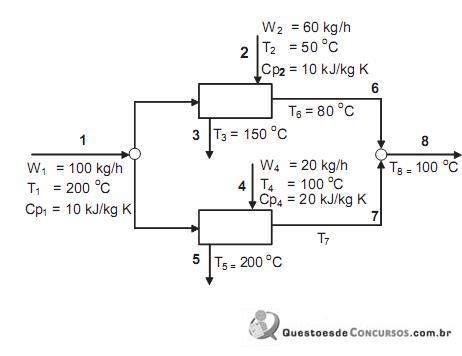 Considerando-se as informações pertinentes mostradas no próprio fluxograma, o valor da temperatura T7 , da Corrente 7,em oC, deve ser
Considerando-se as informações pertinentes mostradas no próprio fluxograma, o valor da temperatura T7 , da Corrente 7,em oC, deve ser