Questões de Concurso
Sobre termodinâmica e equilíbrio de fases em engenharia química e química industrial
Foram encontradas 557 questões
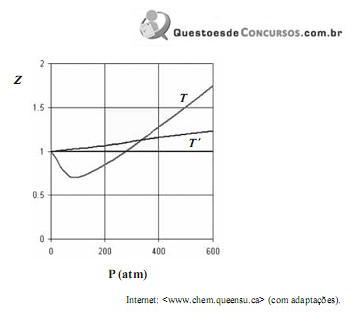
Considerando que, sob pressões elevadas, os gases deixam de apresentar comportamento ideal, e que a figura acima apresenta as curvas do coeficiente de compressibilidade (Z) para o
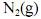 em duas temperaturas distintas (T e T’), julgue os itens subsequentes.
em duas temperaturas distintas (T e T’), julgue os itens subsequentes.A temperatura T é superior à temperatura T’.


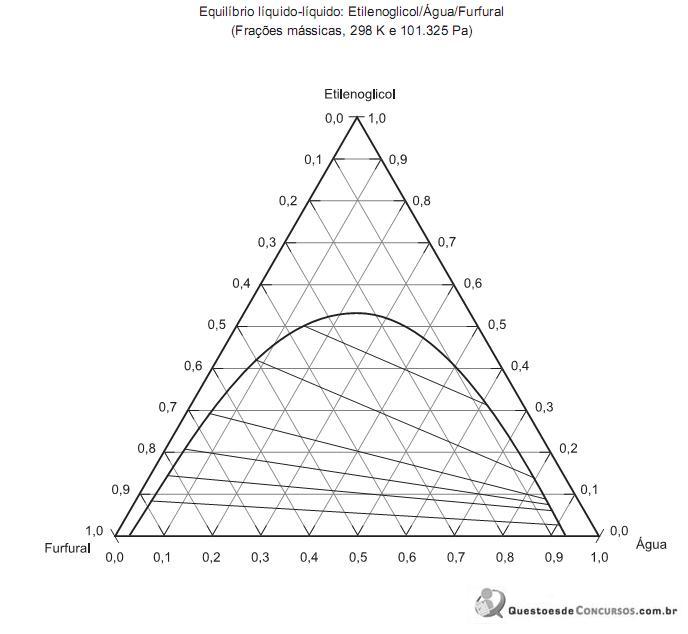
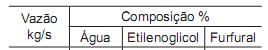
Com relação ao diagrama ternário do sistema etilenoglicol - água - furfural dado, a vazão mássica em kg/s e as composi- ções mássicas da fase extrato, são, respectivamente,
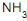 , lava-se essa mistura, em um único estágio, com água reciclada a 293 K contendo uma quantidade de amoníaco de 0,01 mol
, lava-se essa mistura, em um único estágio, com água reciclada a 293 K contendo uma quantidade de amoníaco de 0,01 mol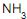 / mol
/ mol 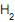 O. A composição do
O. A composição do no produto gasoso é 0,032 mol
no produto gasoso é 0,032 mol / mol ar.
/ mol ar. Dado: Curva de Equilíbrio do Sistema Amoníaco –
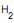 O – Ar a 293 K e 101.325 Pa.
O – Ar a 293 K e 101.325 Pa.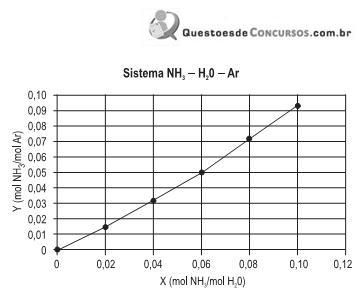
A razão entre a vazão molar do solvente e a vazão molar do ar é
 como as capacidades caloríficas molares, de um gás ideal, a pressão constante e volume constante, respectivamente, e (?) como a razão entre estas capacidades caloríficas
como as capacidades caloríficas molares, de um gás ideal, a pressão constante e volume constante, respectivamente, e (?) como a razão entre estas capacidades caloríficas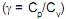 . A equação que relaciona a pressão e o volume de um gás ideal em um processo adiabático reversível, quando estas capacidades caloríficas são constantes, é dada por
. A equação que relaciona a pressão e o volume de um gás ideal em um processo adiabático reversível, quando estas capacidades caloríficas são constantes, é dada por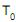 e a uma pressão
e a uma pressão 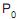 , até um estado final a uma temperatura T e a uma pressão P. Se
, até um estado final a uma temperatura T e a uma pressão P. Se 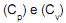 são as capacidades caloríficas molares deste gás, a pressão e volume constantes, respectivamente, e se R é a constante universal dos gases, a expressão para o cálculo da variação de entropia (?S) desse processo é
são as capacidades caloríficas molares deste gás, a pressão e volume constantes, respectivamente, e se R é a constante universal dos gases, a expressão para o cálculo da variação de entropia (?S) desse processo é• um reservatório quente (fonte quente), onde o fluído absorve uma quantidade de calor
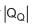 ;
; • um reservatório frio (fonte fria), onde o fluido descarta uma quantidade de calor
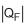 .
. Se a quantidade de trabalho líquido produzida por esse fluído for igual a
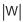 , então a eficiência térmica
, então a eficiência térmica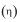 dessa máquina é dada por
dessa máquina é dada por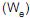 como trabalho de eixo, a equação que expressa a primeira lei da termodinâmica para um processo com escoamento, em estado estacionário, entre uma única entrada e uma única saída, em que as variações de energia cinética e potencial são desprezíveis, é
como trabalho de eixo, a equação que expressa a primeira lei da termodinâmica para um processo com escoamento, em estado estacionário, entre uma única entrada e uma única saída, em que as variações de energia cinética e potencial são desprezíveis, é U + PV e G
U + PV e G H - TS, em que:
H - TS, em que:H = entalpia molar;
G = energia livre de Gibbs molar;
S = entropia molar;
P = pressão;
T = temperatura;
V = volume molar,
para este processo de compressão, conclui-se que
1. de um estado inicial a 100 o C e 1 bar, é comprimido adiabaticamente até 150 o C;
2. em seguida, é resfriado de 150 o C a 100 o C, a pressão constante;
3. finalmente, é expandido isotermicamente até o seu estado original.
Para o ciclo completo, as variações de energia interna (?U) e entalpia (?H) são
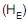 e a energia interna específica do gás no interior do tanque, após o enchimento (U), é
e a energia interna específica do gás no interior do tanque, após o enchimento (U), é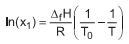
Sabe-se que:
• X1 é a fração molar de solvente em solução que cristaliza na temperatura T;
• ΔfH e T0 são, respectivamente, a variação de entalpia e a temperatura de fusão do solvente puro;
• R é a constante universal dos gases que pode ser aproximada por 2 cal/(mol•K);
• a variação de entropia de fusão do benzeno puro é 8 cal/(mol•K);
• a massa molar do benzeno é 78 g/mol;
• a temperatura de fusão do benzeno (T0) é 278,5 K.
A massa molar do soluto, a 278 K, necessária para a cristalização do benzeno a partir de uma solução de 10 g de soluto em 780 g de benzeno, em g/mol, é
A respeito de operações unitárias na indústria química, julgue os itens seguintes.
O modelo de estágio de equilíbrio, amplamente aplicável às operações unitárias, baseia-se em um dispositivo no qual duas correntes, ou duas fases, são reunidas, entram em equilíbrio e depois são separadas e retiradas.
Em pH 4,0, o potencial elétrico para a referida reação de corrosão do ferro supera, em valor igual a 6,9RT/F, o potencial medido em pH 7,0, considerando-se constantes as atividades de Fe2+ e O2 e a temperatura.
A partir dos dados fornecidos, infere-se que o potencial-padrão, a 25 ºC, para a reação Fe3+ + 3 e- → Fe é maior que 1,0 V.
Em uma peça de aço inoxidável, a proteção contra a corrosão ocorre porque o cromo apresenta menor tendência eletroquímica à oxidação que o ferro.
A reação em questão apresenta cinética de segunda ordem.
à temperatura de 280 K, a pressão de vapor dessa substância é maior que 72,9 atm.
na temperatura de fusão, a fase sólida da substância em apreço apresenta densidade maior que a do respectivo estado líquido.