Questões de Engenharia Química e Química Industrial - Termodinâmica e Equilíbrio de Fases para Concurso
Foram encontradas 492 questões
 , cuja equação de combustão é
, cuja equação de combustão é . A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
. A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
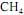 ocorra de forma completa; que a entalpia padrão de combustão do
ocorra de forma completa; que a entalpia padrão de combustão do 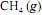 , a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
, a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.A combustão de um mol de
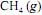 , em condições padrão a 25 ºC, gera uma redução de mais de 1.000 kJ na energia livre de Gibbs do sistema.
, em condições padrão a 25 ºC, gera uma redução de mais de 1.000 kJ na energia livre de Gibbs do sistema. 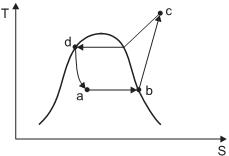
Se as entalpias dos pontos b, c e d são 3.500 kJ/kg, 5.000 kJ/kg e 500 kJ/kg, respectivamente, a vazão do fluido refrigerante (em kg/s) é de
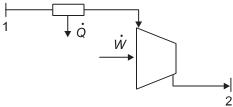
Desprezando-se as perdas de calor em outras etapas, a variação total de entalpia do fluido (em kJ/s e em módulo) no decorrer do referido processo é de

No fluxograma acima, vapor d’água superaquecido no estado 1, a 750 kPa e 650 °C (entalpia igual a -12.108 kJ/kg em relação à mesma referência da tabela de vapor d’água fornecida como anexo a esse caderno de questões), passa por uma válvula e em seguida por uma turbina, saindo do processo como vapor saturado a 82 °C, no estado 2.
Para uma vazão de vapor igual a 1 kg/s, a potência gerada pela turbina (em kW) é de
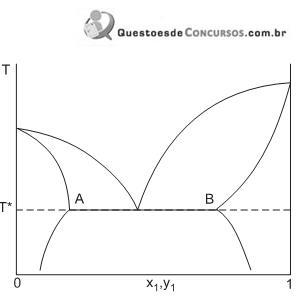
No sistema apresentado na Figura,
Sendo R a constante dos gases, o trabalho de compressão deste gás é dado por:
Mesmo assim, tal relação pode ser aplicada a processos irreversíveis, pois
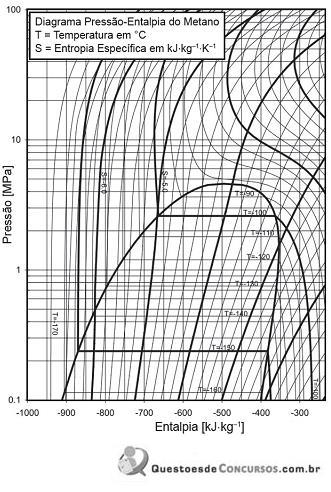
Metano líquido saturado a uma pressão de 0,7 MPa passa por uma expansão isotérmica até uma pressão de 0,2 MPa.
De acordo com o diagrama acima, a variação de entalpia nesse processo (em kJ/kg) é, aproximadamente, de
Neste contexto, a(s)
Assim, usando a relação de Maxwell correspondente, a variação de entropia (dS) T do sistema no referido processo é igual a
(hi representa a entalpia molar do composto i)
hCO(370 o C) - hCO(300 o C) = 2,2 x 103 J/mol
hH2O(370 o C) - hH2O(300 o C) = 2,6 x 103 J/mol
calor de reação a 370 o C ≈ -4 x 104 J/mol
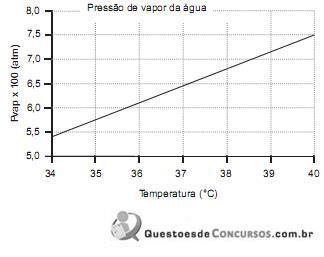
De acordo com o gráfico acima, a temperatura, em graus Celsius, de uma corrente de ar na pressão atmosférica com umidade relativa de 40% e 3% de água em base volumétrica é de, aproximadamente,
Dados
Massa molar da água = 18 g/mol
Massa molar do ar = 29 g/mol
Constante dos gases = 8,314 J/mol/K
“A maior parte [da água da Terra] veio dos asteroides que deram uma contribuição de mais de 50%. Uma pequena parcela veio da nebulosa solar, com 20% de participação e os 30% restantes, dos cometas.”
(Fonte: http://www.inovacaotecnologica.com.br/noticias/noticia.php?artigo=origem-da-agua-da-terra#.VAOaaPldVqU. Acessado em 31/08/2014.)
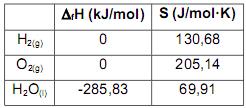
Considerando-se a reação de formação da água líquida a partir de seus elementos, ocorrendo a 25ºC, em condições de temperatura e pressão constantes, e os valores termodinâmicos apresentados a seguir, assinale a alternativa CORRETA.
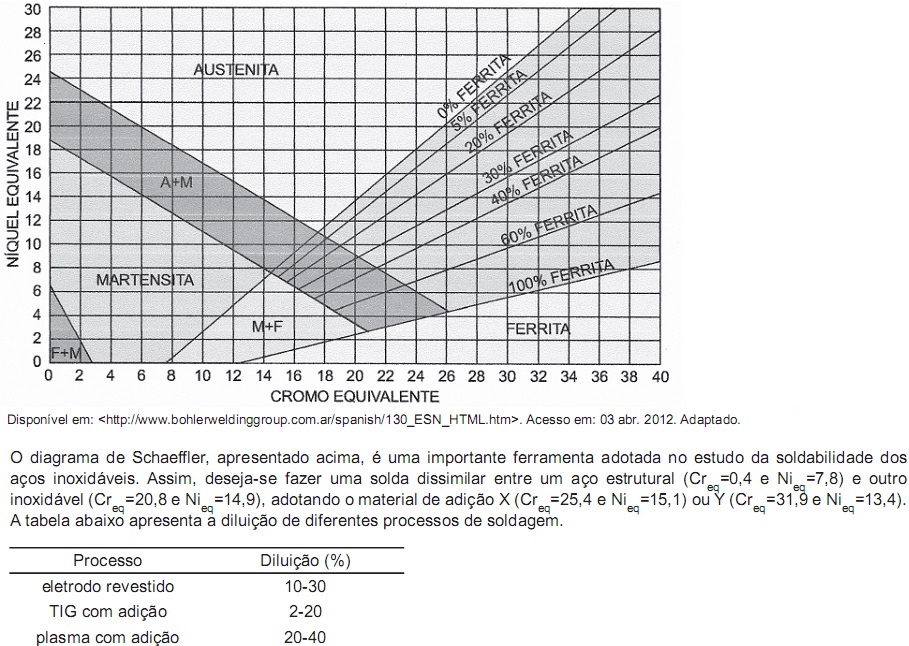
Nesse contexto, para a obtenção de
