Questões de Concurso
Sobre termodinâmica e equilíbrio de fases em engenharia química e química industrial
Foram encontradas 511 questões

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 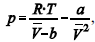 julgue o item que segue.
julgue o item que segue.
Quando atingida a pressão de 300 atm e a temperatura T2, o
volume ocupado pelo gás será menor do que aquele que seria
ocupado, nas mesmas condições, por um gás ideal.

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 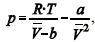 julgue o item que segue.
julgue o item que segue.
A uma pressão de 1,00 atm e temperatura de 300 K, o volume
ocupado pelo O2 (g) formado na decomposição de 4,00 mol de
H2O2 será superior a 46,0 L.
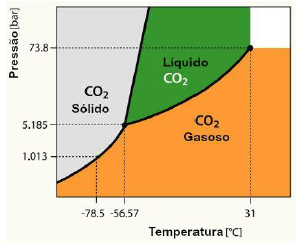
Observe o gráfico que demonstra a região de duas fases e a continuidade dos estados.
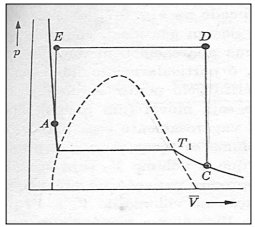
De acordo com a figura anterior, analise as afirmativas a seguir.
I. Os pontos A e C pertencem à mesma isoterma.
II. O ponto C representa um estado gasoso e o ponto A um sólido obtido comprimindo-se o gás isotermicamente.
III. A reta EA mostra quando o volume é mantido constante e o gás é resfriado, diminuindo a pressão.
IV. Em nenhum instante dessa série de mudanças o ponto que representa o estado do gás passou através da região de duas fases.
Estão corretas as afirmativas
Afirma-se que ΔG é o critério básico de espontaneidade. Uma reação ocorre espontaneamente se ΔG tem valor negativo. Lembrando que por tratamento termodinâmico, a fórmula da variação da energia livre padrão é definida por: ΔGo = – RT ln K. Se substituirmos R por 8,31 x 10–3 (quilojoules por Kelvin) e ln K por 2,30 log10 K, tem-se a seguinte fórmula descrita:
ΔGo (em quilojoules) = –2,30(8,31 x 10–3 )T log10K = –0,0191T log10K
Assinale a alternativa que NÃO contempla a energia livre padrão em sua fórmula substituída:
Sendo (pf ,Tf ), respectivamente, a pressão e a temperatura ao fim do processo acima, podem ser escritas essas duas grandezas, em função de (p0 ,T0 ), como:
Sejam projetos independentes de uma absorvedora e de uma esgotadora. Sabe-se que:
ABSORVEDORA: foram fixadas a vazão molar do gás, sua composição na entrada e na saída (razões molares: Y1 e Y2 , respectivamente) e a composição do solvente na entrada (X2 ). Para vazões molares do solvente em dois valores diferentes (A e B), foram obtidas as retas de operação exibidas na Figura (I), que também apresenta a linha de equilíbrio.
ESGOTADORA: foram fixadas a vazão molar do líquido, sua composição na entrada e na saída (razões molares: X2 e X1 , respectivamente) e a composição do gás na entrada (Y1 ) Para vazões molares do gás inerte em dois valores diferentes (C e D), foram obtidas as retas de operação exibidas na Figura (II), que também apresenta a linha de equilíbrio.
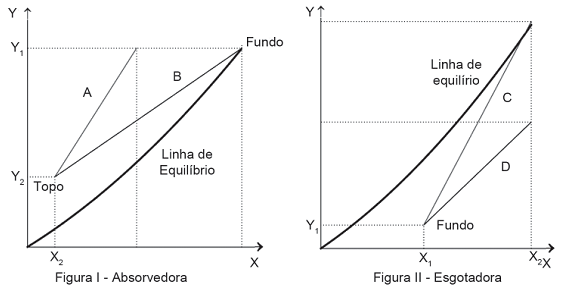
Na prática, a(s) condição(ões) de projeto a ser(em) evitada(s) é(são)
Uma mistura binária ideal líquido-vapor com os componentes 1 e 2 está em equilíbrio e tem a pressão total P0 . A pressão parcial do componente 1 é mantida sempre como o dobro da pressão parcial do componente 2.
Nessas condições, ao reduzirmos a fração molar na fase líquida do componente 2 em 2/3, nova pressão no sistema, em função de P0 , será
Passando por um processo termodinâmico cuja variação de temperatura é ΔT0 , um gás ideal sofre uma variação de energia interna ΔE0 .
Se reduzirmos o número de mols à metade e triplicarmos a variação de temperatura, a variação da energia interna do gás será
Moléculas de água dispersas no ar são adsorvidas em uma superfície sólida, atomicamente lisa, formando pequenas gotículas de água. Nesse sistema, o trabalho de adesão entre a superfície e a água é W0 , e a energia da interface água vapor é 2W0 /3.
Nesse caso, o cosseno do ângulo de contato formado pelas gotas de água com a superfície é
O diagrama de ponto de ebulição da Figura é dado em função da concentração da substância A na mistura A-B.
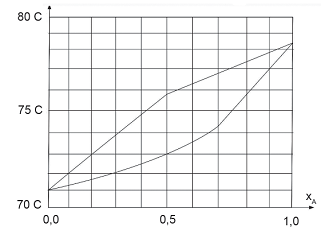
Qual é a razão entre a concentração molar de A na fase
vapor, em relação à líquida para a isoterma de 73°C
(fator K)?
Podemos medir a tensão superficial de um fluido pelo método da gota caindo por um tubo fino de raio R, como ilustrado na Figura.
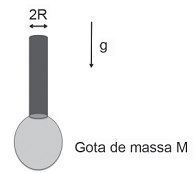
Se a massa da gota imediatamente antes de cair era M, a
tensão superficial do fluido 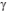 é dada por
é dada por
A seguir têm-se quatro afirmações sobre o comportamento de um gás ou de uma mistura de gases encerrados em recipientes de volumes constantes. Observe-as:
I - Na mesma temperatura, quantidades iguais, em mol, de dois gases, que se comportam idealmente, exercem pressões parciais diferentes por terem massas molares diferentes.
II - Quando o fator de compressibilidade de um gás (Z) é igual a 0,5, pode-se considerar que ele se comporta idealmente.
III - O volume ocupado pelo gás, que se comporta idealmente, é diretamente proporcional à sua temperatura.
IV - Dois gases, que se comportam idealmente e não reagem entre si, têm a pressão total igual à soma das pressões exercidas por cada gás individualmente.
É correto APENAS o que se afirma em
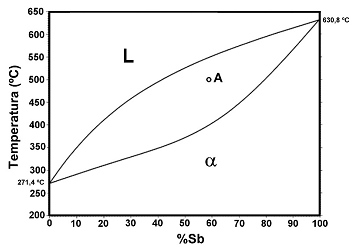
A figura a seguir mostra um diagrama de fase binário Bi-Sb (bismuto-antimônio). Neste diagrama é indicado um ponto “A” que corresponde a uma liga Bi-Sb com 60%Sb a 500 ºC. Considere todas as condições quando o equilíbrio de fases é alcançado e escolha a opção correta.