Observe o gráfico a seguir.Sabendo que 20 mols de um gá...
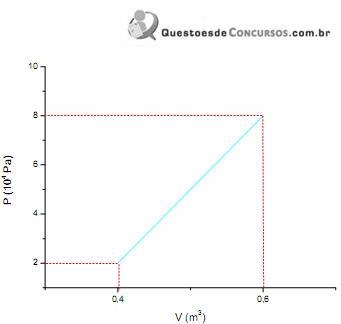
Sabendo que 20 mols de um gás perfeito sofreu uma determinada variação indicada pelo diagrama de trabalho anterior, é correto afirmar que a quantidade de calor recebida pelo sistema foi de, aproximadamente,
(Considere: R = 8,31 J/mol . K.)
Comentários
Veja os comentários dos nossos alunos
o único jeito de chegar ao resultado é considerando o diagrama PV molar !
Considerando-se o modelo de gás ideal (PV=nRT), calcula-se a Temperatura para cada um dos estados - inicial e final.
Encontrei T1=50K e T2=300K.
Sabe-se, também que a variação de energia interna para um gás ideal é dada por U = (3/2)*n*R*T
Calcula-se, então, a variação de energia interna pro gás - utilizando deltaT = 250K.
Encontrei U = 6x10^4 J
Calcula-se, ainda, o trabalho de expansão pelo gás (considerei expansão contra pressão constante de 8x10^4 Pa), através da equação
W = -P(Vfinal - Vinicial).
Encontrei -1,6x10^4 J
Como se trata de uma expansão, o valor é negativo mesmo, pois o trabalho é realizado pelo gás sobre o sistema.
De acordo com a primeira lei da termodinâmica, U = Q + W.
Desse modo, tendo U e W, pode-se calcular Q.
Q = U - W = 6x10^4 - (-1,6x10^4) = 6,6x10^4 J.
Como utilizei em minhas contas R = 8 J/K. mol, não obtive um resultado mais acurado.
No entanto, o valor mais próximo seria 7x10^4 J, que é o gabarito.
Acho que essa questão está inconsistente, faltam dados para chegar à resposta.
O trabalho pode ser encontrado a partir da área abaixo da curva, mas para o cálculo do calor, é necessário a informação sobre a variação de energia interna.
Ele só diz que é um gás perfeito, não fala se é monoatômico, poliatômico linear ou não linear, o que influencia no cálculo de ΔU.
1) Encontrar o trabalho W
W = Área
Wtriângulo = b . h / 2 = (0,2 . 6.10⁴) / 2 = 0,6.10⁴ J
Wquadrado = b . h = (0,2 . 2.10⁴) = 0,4.10⁴ J
Wtotal = 1. 10⁴ J = 10.000 J
2) Encontrar a Temperatura T₁ e T₂
p₁ . V₁ = n . R . T₁
T₁ = p₁ . V₁ / n . R = [(2.10⁴) . (0,4)] / [(20) . (8,31)]
T₁ = 48 K
T₂ = p₂ . V₂ / n . R = [(8.10⁴) . (0,6)] / [(20) . (8,31)]
T₂ = 288 K
3) Encontrar a Energia Interna E₁ e E₂
E₁ = (3 . n . R . T₁) / 2
E₁ = (3 . 20 . 8,31 . 48) / 2
E₁ = 11.966 J
E₂ = (3 . 20 . 8,31 . 288) / 2
E₂ = 71.798 J
ΔE = 59.832 J
4) PPT
ΔU = ΔE = Q – W
Q = ΔU + W
Q = 59.832 + 10.000
Q = 69.832
Q = 7.10⁴ J
Gabarito: Letra D
Bons estudos!
Faltou dizer se o gás era monoatômico.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo