O diagrama de fases pode ser representado por gráficos em f...
As equações para a pressão de vapor do NaF sólido e líquido com a pressão são, respectivamente, as seguintes:
Inp =
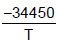 - 2,01lnT + 33,740 Inp =
- 2,01lnT + 33,740 Inp = 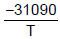 - 2,52lnT + 34,660
- 2,52lnT + 34,660 O calor de fusão, ∆H, do fluoreto de sódio (NaF), no ponto triplo, em KJ, é
Dado pressão na equação em (atm), temperatura na equação em (K) e constante dos gases R = 8,3144 JK-1 mol-1
Comentários
Veja os comentários dos nossos alunos
Solução:
A solução da questão é feita utilizando uma variação da equação de Clapeyron para a pressão de saturação:
dp/P = H/RT^2 dT - (H - Entalpia de mudança de fase, R - Constante dos gases, P - Pressão de Saturação, T - Temperatura Absoluta)
A dificuldade da questão é que não podemos considerar a equação par aH como constante, mas sim como sendo:
H = H0 + CP(T - T0) - (H0 - Entalpia em alguma temperatura de referência, Cp - Diferença de Cp das fases)
Integrando a equação, ficamos com uma relação da forma:
ln P = -1*(H0-CpT0)/R * 1/T + Cp/R * LnT + Cte
Agora, para estimar a entalpia na temperatura, pegamos os seguintes valores:
- Sólido
(H0-CpT0)/R = 34450
Cp/R = 2.01
H sólido = R*((H0-CpT0)/R + T*Cp/R)
H sólido = 8.3144*(34450 - 2.01*1260)
H sólido = 265374.03 J/mol
- Líquido
(H0-CpT0)/R = 31090
Cp/R = 2.52
H líquido = R*((H0-CpT0)/R + T*Cp/R)
H líquido = 8.3144*(31090 - 2.52*1260)
H líquido = 232094.81 J/mol
Portanto, Hfusão = Hsólido - Hliquido
Hfusão = 33279.21 J/mol
Hfusão = 33.3 KJ/mol ( Aprox)
Se alguém tiver uma solução que a pessoa não passe 30 min multiplicando, por favor, me ajude.
dlnp/dT=ΔHsv/pT ΔVsv
34450/T2-2,01/T = ΔHsv/pT ΔVsv
31090/T2-2,52/T = ΔHlv/pT ΔVlv
ΔVsv= ΔVlv =V
p=RT/ V
34450-2,01T = ΔHsv/R
31090-2,52T = ΔHlv/R
ΔHsv- ΔHlv= ΔHsl= (3360+0,51T)R= (3360+0,51*1260)*8,314=33,3 kJ/mol
Olá,
Poderia me explicar como fez para integrar a equação: dp/P = H/RT^2 dT ?
Tentei integrar, mas não deu o mesmo resultado.
Se tiver como, ficarei muito grato.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo