Questões de Concurso
Sobre 1ª lei da termodinâmica em física
Foram encontradas 150 questões
A figura a seguir ilustra um diagrama T–S (temperatura (T) versus entropia (S)) de um motor que obedece a um ciclo de Carnot ideal, tendo como substância de trabalho um gás ideal.

Considerando que o trabalho realizado por esse sistema seja igual a 3.000 J, julgue o próximo item.
A energia recebida pelo sistema é de 4.000 J
O estudo do calor e de suas transformações em energia mecânica é chamado de termodinâmica, que significa “movimento do calor”. A ciência da termodinâmica foi desenvolvida no início do século XIX, antes que a teoria atômica e molecular da matéria fosse compreendida.
P. Hewitt. Física Conceitual. 9.ª edição (com adaptações).
A respeito da termodinâmica, assinale a alternativa correta.
No cotidiano, há a ocorrência de diversos fenômenos térmicos, os quais estão associados aos conceitos de calor, temperatura, energia, entre outros. Com relação aos princípios relacionados à termodinâmica e suas aplicações, julgue o item a seguir.
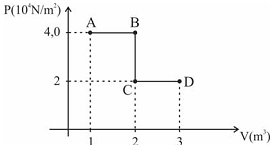
Considere que o diagrama abaixo ilustre a transformação sofrida por 1 mol de gás ideal. Nesse caso, é correto afirmar que o trabalho realizado por esse gás, no trecho BCD, é igual a 2 × 104 J.
No cotidiano, há a ocorrência de diversos fenômenos térmicos, os quais estão associados aos conceitos de calor, temperatura, energia, entre outros. Com relação aos princípios relacionados à termodinâmica e suas aplicações, julgue o item a seguir.
De acordo com a 1.ª lei da termodinâmica, o calor fornecido a
um sistema é utilizado para aumentar a energia interna do
sistema e realizar trabalho.
Nos sistemas estacionários, a variação da energia total corresponde à(ao)
Uma geladeira de isopor com 1,00 m2 de área da base e espessura de 4,00 cm possui um coeficiente de condutividade térmico igual a 0,01 W/m×K. Se a temperatura em seu interior está a 2,0 °C, e no exterior, está a 25,0 °C, a quantidade de calor dissipada pela base da geladeira, em um período de 12 horas, é igual a
Em relação à grandeza de temperatura termodinâmica no sistema internacional de unidades (SI), analise.
I. Os símbolos de grandeza e dimensão são, respectivamente, T e Θ.
II. kelvin ou grau kelvin constitui sua unidade, sendo representada por °K.
III. kelvin é a fração 1/273,16 da temperatura termodinâmica do ponto triplo da água.
Está(ão) correta(s) apenas a(s) afirmativa(s)
A figura mostra, em um diagrama p – V, a evolução de uma certa massa de um gás ideal, entre dois estados de equilíbrio térmico A e B.
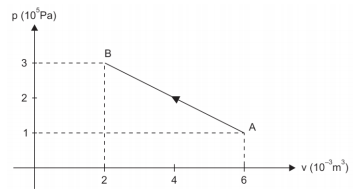
Considerando positiva a quantidade de calor trocada pelo gás com a vizinhança quando ela é recebida pelo gás, e negativa quando ela é cedida, a quantidade de calor que o gás trocou com sua vizinhança, ao evoluir de A até B, foi

Um ar condicionado deve ser utilizado para manter o ambiente em 22º C. A carga térmica a ser removida deste ambiente é igual a 5 KW. Sabendo que o ambiente externo está em 34º C, a potência necessária para acionar o equipamento é
Um fluido é movimentado por um agitador. O trabalho fornecido ao agitador é 5782 kJ e o calor transferido do tanque é 2232 kJ. Considere o tanque e o fluido como um sistema. Utilizando a primeira lei da termodinâmica, determine a variação da energia do sistema acima.
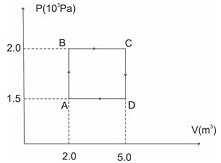
Considerando a figura acima, que ilustra um processo cíclico
representado por um diagrama P × V em que a substância trabalho
consiste em dois moles de oxigênio gasoso, assinale a opção que
apresenta, em joules, o valor do trabalho realizado pelo gás no ciclo
ABCDA.
Um gás ideal de Van der Waals é caracterizado por duas
equações de estado, que consistem em um melhoramento em
relação às equações de um gás ideal, quanto à correta descrição de
gases reais de mais alta densidade. As equações de estado do gás
ideal de Van der Waals podem ser expressas da seguinte maneira:
 em que P corresponde à pressão,
T, à temperatura, V, ao volume, U, à energia interna e N, ao número
de moles.
em que P corresponde à pressão,
T, à temperatura, V, ao volume, U, à energia interna e N, ao número
de moles.
A constante universal dos gases é  e c, a
e b são constantes que dependem da natureza específica do
gás. Para um gás de oxigênio O2, por exemplo, tem-se c = 2,5;
a = 0,138 Pa.m6
e b = 32,6 x 10-6 m3
.
e c, a
e b são constantes que dependem da natureza específica do
gás. Para um gás de oxigênio O2, por exemplo, tem-se c = 2,5;
a = 0,138 Pa.m6
e b = 32,6 x 10-6 m3
.
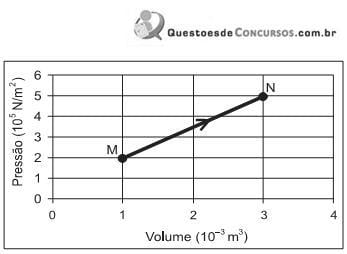
Se, durante essa transformação, o sistema recebeu 900 J de calor, a variação aproximada da sua energia interna foi de
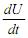 = S(1 - ρ ) - εσ T4.
= S(1 - ρ ) - εσ T4.