Questões de Concurso
Comentadas sobre cinética química em química
Foram encontradas 540 questões
A cinética química estuda a velocidade com que as reações químicas se processam. Sobre cinética química julgue os itens a seguir.
I . Quanto mais alta a energia de ativação mais lenta será a reação.
II. Quanto menor a concentração dos reagentes, mais lenta será a reação.
III. Reações envolvendo reagentes exclusivamente no estado gasoso têm sua velocida de aumentada quando se diminui a pressão.
Está(ão) correta(s) a(s) sentença(s):
Átomos diferentes que apresentam o mesmo número de nêutrons são chamados:
Uma reação química foi realizada a uma temperatura T e a uma pressão p A reação é do tipo A + B → C. Foram realizados três experimentos na qual se obteve uma velocidade de reação conforme indicado.
|
Experimento |
[A] (mol/L) |
[B] (mol/L) |
Velocidade Relativa |
1 |
0,010 |
0,002 |
4V |
2 |
0,005 |
0,002 |
1V |
3 |
0,010 |
0,004 |
4V |
A partir dessas informações podemos afirmar que:
São poucas as reações químicas que ocorrem em um único sentido, sendo a maior parte das reações reversível, em maior ou menor extensão. Quando as velocidades das reações direta e inversa forem iguais e as concentrações dos reagentes e dos produtos não variarem com o tempo, atinge-se o:
A decomposição de uma determinada espécie gasosa A ocorre de acordo com a reação representada abaixo.
2 A(g) → 4 B(g) + C(g).
Se a velocidade de decomposição da espécie A, em determinado instante no reator, for 8,2 x 10-7 mol L-1 s-1, a velocidade de formação da espécie B, expressa em mol L-1 s-1, será aproximadamente
Considere que 1,0 mg de fosfato de potássio, com 90% de pureza, reagiu completamente com 100,0 mL de uma solução aquosa de ácido sulfúrico. Assim, a normalidade da solução do ácido será aproximadamente
Dados: Massas molares (g mol-1): H = 1; O = 16; S = 32; P = 31; K = 39
A ustulação é um processo químico utilizado na metalurgia, que consiste em aquecer um sulfeto na presença de gás oxigênio. A ustulação completa da pirita está representada pela equação química abaixo:
4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2.
Ao submeter a esse processo 200 toneladas de pirita com 80% de pureza, o volume de SO2 obtido nas CNTP, expresso em m3 , será aproximadamente
Dados: Massas molares (g mol-1): O = 16; S = 32; Fe = 56
Se 30,0 mL de uma solução 0,1 mol L-1 de KMnO4 foram reduzidos em meio ácido por 15 mL de outra solução, então, a normalidade da solução redutora é igual a
Uma amostra de calcário (CaCO3) pesando 1,5 g foi tratada com 50,0 mL de uma solução aquosa 0,25 mol L-1 de ácido clorídrico. A solução resultante foi cuidadosamente fervida para a eliminação total do CO2, bem como do excesso de ácido titulado por 3,0 mL de uma solução aquosa M/6 de NaOH. Assim, a pureza do calcário analisado, expressa em termos do porcentual de CaO e de CaCO3, é, respectivamente,
Dados: Massas molares (g mol-1): C = 12; O = 16; Ca = 40
I. Existem três variáveis que afetam as velocidades de reação: concentração, estado físico dos reagentes e temperatura. II. As equações de velocidade podem ser escritas para expressar como as concentrações variam com o tempo. III. Em nível molecular, as velocidades de reação dependem da frequência das colisões entre as moléculas, quanto maior a frequência das colisões, menor a velocidade de reação.
É correto afirmar que:
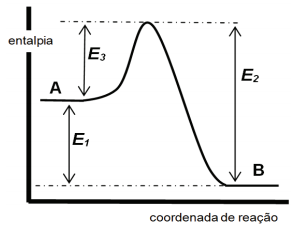 ( ) corresponde à entalpia da reação direta
( ) corresponde à energia de ativação da reação direta
( ) corresponde à entalpia da reação inversa
( ) corresponde à energia de ativação da reação inversa
( ) corresponde à entalpia da reação direta
( ) corresponde à energia de ativação da reação direta
( ) corresponde à entalpia da reação inversa
( ) corresponde à energia de ativação da reação inversa
Assinale a alternativa correta:
Assinale a alternativa correta:
Se colocados 100,0 g de Al(s) e 40,0 g de Cr2 O3 em alta temperatura, ocorrerá uma reação de oxidação de alumínio seguindo a reação: 2 Al(s) + Cr2 O3 (s) → Al2 O3 (s) + 2 Cr(l). Identifique qual será o reagente limitante desta reação e quantifque (em gramas) o excesso de reagente que permanece sem reagir. Dados: 1 mol de Al = 27 g Al, 1 mol de Cr2 O3 = 152,0 g Cr2 O3 .
Assinale a alternativa que possui ambas respostas corretas.