Questões de Concurso
Comentadas sobre cinética química em química
Foram encontradas 538 questões
NH4 + + HNO2 → N2 + 2 H2O + H+
Cujo mecanismo é:
NH4 + → NH3 + H+ (Rápida) HNO2 → H2O + NO+ (Rápida) NO+ + NH3 → NH3NO+ (Lenta) NH3NO+ → N2 + H2O + H+ (Rápida)
Com relação ao exposto, assinale a alternativa que apresenta corretamente a expressão da lei da velocidade diferencial para a reação do HNO2 com NH4 +.
–d[A] / dt = –d[B] / dt = d[C] / dt = d[D] / dt = k[A]a . [B]b
Com relação à ordem da reação (a, b e a + b), assinale a alternativa correta
1.(__) O pH ótimo para a atividade enzimática é o mesmo para todas as enzimas, independentemente do seu ambiente de atuação.
2.(__) Enzimas alteram o equilíbrio químico da reação, favorecendo a formação de produtos ou reagentes.
3.(__) Enzimas diminuem a energia de ativação necessária para as reações químicas, aumentando a velocidade da reação sem alterar o equilíbrio químico.
A sequência CORRETA é:
A + A + B
 C + D
C + D A molecularidade dessa reação é:
k = A e – Ea/RT
Sobre a Equação, sejam feitas as seguintes proposições:
I. A constante de velocidade aumenta exponencialmente com o aumento da energia de ativação e diminuindo a temperatura.
II. A constante de velocidade diminui exponencialmente com o aumento da energia de ativação e a diminuição da temperatura.
III. A constante de velocidade aumenta exponencialmente com a diminuição da energia de ativação e diminuindo a temperatura.
IV. A constante de velocidade aumenta exponencialmente com a diminuição da energia de ativação e aumento da temperatura.
Está correto apenas o que se afirma em
A zimografia, no entanto, é um método versátil e amplamente utilizado para avaliar o perfil de proteínas de um substrato. Com isso, a zimografia pode ser adaptada para investigar diferentes enzimas, substratos e sistemas biológicos, contribuindo para a compreensão de processos metabólicos, regulação enzimática e diagnóstico de doenças. Considerando os princípios, tipos, usos e aplicações da técnica de zimografia, assina a afirmativa incorreta.
I. há excesso de substrato em relação à concentração de enzima;
II. a concentração do complexo enzima-substrato produzido é imediatamente consumido;
III. as concentrações de enzima e substrato se modificam consideravelmente.
Analise os itens acima e assinale
Nessa abordagem, no caso de uma titulação redox monitorada com um eletrodo combinado, graficamente obtém-se a(o)
A lei de velocidade dessa reação, nas condições mencionadas, é a
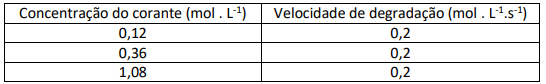
Os dados experimentais apresentados na tabela sugerem uma lei cinética de degradação de ordem:
Julgue o próximo item, acerca da caracterização de nanomateriais.
O potencial zeta está relacionado à carga no interior da
nanopartícula.
No que se refere à modificação de superfícies, julgue o seguinte item.
A funcionalização de superfícies antimicrobianas é uma
tecnologia que pode ser utilizada para desinfecção em vários
ramos da atividade humana, por exemplo, na esterilização de
dispositivos médicos para prevenir infecções hospitalares.
Julgue o item que se segue, acerca de modificações de superfícies de biomateriais com proteínas.
Todos os métodos de modificação de superfícies de
biomateriais são essencialmente métodos químicos.
Uma solução de ácido clorídrico foi utilizada para a neutralização de 50g de soda cáustica (NaOH) com pureza de 90%. Para tal reação de neutralização foi consumido exatamente 500 ml de solução. Assinale a alternativa que contém a concentração de HCl da solução utilizada na neutralização:
Uma solução saturada de KCl(aq) foi preparada adicionando 37,25 g do sal em 100 ml de água destilada. Em outro recipiente foi diluído um mol de HCl em 100 ml de água destilada. As duas soluções foram diluídas formando uma solução não saturada. Assinale a alternativa que apresenta o número de mols de potássio (K) a ser dissolvido nessa solução final para que ela fique novamente saturada?
Massa molar: K=39 g/mol; Cl=35,5g/mol.
“A meia-vida, t1/2, de uma substância é o tempo necessário para que sua concentração caia à metade do valor inicial”. A figura abaixo mostra a concentração do cloreto de butila (C4H9Cl) como uma função do tempo:
(ATKINS; JONES, Princípios de Química: questionando a vida moderna e o meio ambiente, Editora Bookman, 2006)
Variação da Concentração com o Tempo
Fonte: BROWN; LEMAY; BURSTEN, Química: a ciência central, São Paulo: Pearson Prentice Hall, 2005, p. 487
Pode-se concluir, observando o gráfico, que a meia-vida da reação de C4H9Cl com água ocorre aproximadamente no tempo de: